Neste capítulo estudaremos 3 porinas. Porinas são
proteínas de grande peso molecular encontradas tipicamente em
membranas externas de bactérias. Estas membranas, compostas de
lipídeos e peptideoglicanos, são bastante
impermeáveis. Para permitir a entrada de nutrientes
hidrofílicos, as membranas apresentam as porinas.
A primeira destas proteínas que estudaremos é proveniente
de uma bactéria chamada Rhodobacter
capsulatus.
Vamos iniciar o estudo vendo uma animação da
função
desta porina.
| ver
animação |
| visualizar modelo da porina de Rhodobacter capsulatus |
Em realidade, o modelo representa a forma trimérica da porina,
ou
seja, a composição por 3 subunidades idênticas.
| destacar subunidades |
Lembre-se que a porina é uma proteína que se encontra
inserida
na membrana lipídica. Lembre-se que proteínas são
formadas de aminoácidos polares
e apolares.
Veja abaixo a distribuição destes aminoácidos na
porina
em estudo.
| ver aminoácidos polares |
| ver aminoácidos apolares e hidrofóbicos |
Observe que há uma "faixa" apolar ao redor da proteína, próxima à região extracelular.
Esta é a região da proteína que faz contato com os lipídios e por isso é apolar. Observe também que o interior do poro é constituído de vários aminoácidos hidrofílicos, coerente com o fato que este poro serve para o transporte de água e de íons solvatados.
O que você imagina que acontece com a porina se for retirada deste ambiente apolar? A estrutura dela se manteria igual? E a função?
Podemos ainda visualizar as moléculas de água que foram
cristalizadas
juntamente com a proteína.
| visualizar moléculas de água (em uma das subunidades apenas) |
Como o átomo de hidrogênio é pouco denso
eletronicamente,
sua "observação" experimental é difícil
(neste
caso através da difração
de raios X) e portanto somente os
átomos
de oxigênio
são mostrados.
Você pode observar que há uma baixa densidade de
moléculas
de água na faixa hidrofóbica em relação ao
interior do poro, coerente com a polaridade dos aminoácidos na
região.
Proteínas de membrana são bastante difíceis de
cristalizar,
uma vez que sua estrutura depende do meio em que se encontra (a
membrana).
Isto vale para todas as proteínas, a interação com
o meio em que se encontra é fundamental para a
manutenção
de sua estrutura. Devido à dificuldade em manter a estrutura de
proteínas de membrana intacta em meio aquoso, é comum
adicionar
moléculas com caráter apolar para extrair tais
proteínas
e assim obter um cristal.
Na proteína deste estudo, podemos observar moléculas de
N-octiltetraoxietileno.
| visualizar moléculas de N-octiltetraoxietileno |
Perceba que as moléculas de detergente estão ligadas justamente na face hidrofóbica da proteína.
Vamos agora examinar a estrutura secundária da porina.
| visualizar esqueleto peptídico |
Você poderia dizer que estrutura secundária é
predominante?
| visualizar representação do esqueleto peptídico em cartoons (folhas beta, hélices alfa e estrutura aleatória) |
Que tipo de folha-beta pregueada é observada?
A direção das setas (do N para o C-terminal) indica que
trata-se
de folhas-beta pregueadas anti-paralelas. Tal estrutura é
comumente
observada em proteínas de membrana. Na realidade, é
possível
agrupar proteínas com base nas formas de
organização
da estrutura secundária (folds ou dobramentos). A
conservação de um
fold durante a evolução
é uma indicação que tal forma de
estruturação
é bastante importante, biologicamente.
Este fold provê a estruturação
necessária
à formação de um poro central. Também, como
já estudado na seção Estrutura
secundária: folhas beta, a
forma
mais estável para uma organização deste tipo de
estrutura
secundária é a formação de uma "bola",
possibilitando
que a proteína se organize de forma a penetrar a membrana.
Assim, a função da porina é intimamente associada
à sua estrutura: tanto pela i-formação do poro
pelo
fold
de folhas-beta anti-paralelas como ii-pela disposição dos
aminoácidos hidrofóbicos/hidrofílicos, que
possibilita
a inserção desta na membrana.
Diferentes espécies de bactérias possuem diferentes porinas. Embora a função seja a mesma, as porinas podem diferir consideravelmente umas das outras. Um outro exemplo de porina, é a proteína MspA de Mycobateria smegmatis. Esta porina é encontrada na membrana externa dessas bactérias e sua função é o transporte de nutrientes hidrofílicos diversos, sendo a única passagem pela membrana, que forma uma capa impermeável.
Clique o botão abaixo para inciar o estudo da porina de M. smegmatis.
| visualizar modelo atômico da porina de M. smegmatis (vista da face extracelular) |
Esta porina também é multimérica (um octâmero formado por monômeros idênticos). Note a perfeita simetria da estrutura.
| visualizar monômeros que formam esta porina |
A estrutura desta porina é bastante diferente daquela de R.
capsulata.
Embora também seja homomultimérica, os monômeros
formam
juntos um só canal.
A proteína formada é ligeiramente torcida, devido ao
entrelaçamento
dos monômeros.
Embora tão diferente da porina de R. capsulata, esta também é composta basicamente por folhas-beta.
| visualizar
estruturas secundárias (alfa-hélices
e folhas-beta) |
O canal formado não é um cilindro perfeito, sofre uma constrição ao longo de seu comprimento. Neste caso, a constrição se dá bem próxima à face citoplasmática.
Similarmente à porina de R. capsulata, a
aquaporina
é notavelmente hidrofóbica, possibilitando sua
inserção
na membrana lipídica.
| selecionar aminoácidos hidrofóbicos |
Novamente, note que a porção inferior da proteína,
que está inserida na membrana, é bastante
hidrofóbica,
mais que a parte mais proximal à face extracelular. Utilize a
opção
de aumento no painel de controle para visualizar o interior do poro em
detalhes. Você irá observar que o interior deste por
é
muito mais largo e menos hidrofóbico que aquele da aquaporina.
Perceba
também a existência de um anel hidrofóbico no
interior
do canal.
| ver
anel hidrofóbico (Leucina 88,
Isoleucina105 e Isoleucina 89) |
| veja o anel hidrofóbico de dentro do canal |
Como a proteína é composta por 8 unidades
idênticas,
o anel é formado pelos aminoácidos isoleucina 89 e 105 e
leucina 105 de cada subunidade.
Aquaporinas
Uma outra proteína funcionalmente similar às porinas
bacterianas
são as aquaporinas, sendo que estas são encontradas em
células
eucariotas, como em humano, por exemplo. A função destas
porinas é ligeiramente diferente das porinas bacterianas. As
aquaporinas,
como o nome sugere, têm a função de permitir a
passagem
de moléculas de água pela membrana, sem permitir a
entrada
de solutos.
Como se pode imaginar, tais proteínas são de imensa
importância
para a manutenção do equilíbrio hídrico de
certas células. Por exemplo, a pele de anfíbios como sapo
são bastante permeáveis à água,
graças
à presença de aquaporinas. Tais proteínas
são
encontradas de bactéria a humanos.
As aquaporinas são divididas em:
É interessante notar que as aquaporinas
não
são permeáveis a outros íons, apresentando um
mecanismo
de seleção fantástico.
Vamos estudar um modelo atômico de uma aquaporina de boi.
| visualizar modelo da aquaporina 1 de Bos taurus |
Os átomos da AQP1 estão representados pelos seus raios de
Van der Waals, dando uma idéia do volume real ocupado por
eles.
Observe a existência de 4 poros dispostos simetricamente.
| delimitar poros (face citplasmática em laranja, face extracelular em amarelo) |
Na realidade, a AQP1 também é uma proteína formada
por várias subunidades idênticas, cada uma constituindo um
poro (similarmente à porina de R. capsulata).
| colorir os monômeros da AQP1 |
Como você pode observar, os 4 monômeros são
idênticos,
cada um formando um poro distinto.
| visualizar molécula de água no poro (dentro do monômero azul) |
A esfera vermelha dentro do poro é o átomo de oxigênio de uma molécula de água que se encontra no interior deste.
Similarmente à porina de R. capsulata, a
aquaporina
é notavelmente hidrofóbica, possibilitando sua
inserção
na membrana lipídica.
| selecionar aminoácidos hidrofóbicos |
Perceba a faixa hidrofóbica que circunda a aquaporina. Esta é a regiào de contato com a membrana. Note que as faces expostas à água (extra e intracelular) são compostas por uma menor quantidade de aminácidos apolares.
Como visto na porina de R. capsulata, é comum observar
moléculas
de detergente que foram utilizadas na cristalização.
| visualizar moléculas de B-nonilglicosídio |
Novamente, verifique que tais moléculas encontram-se ligadas à face hidrofóbica da proteína.
Estruturas
secundárias da AQP1
Vamos agora estudar a estrutura secundária da aquaporina 1.
| mostrar esqueleto peptídico |
Observa-se que a AQP1 é formada basicamente por
alfa-hélices,
diferentemente das duas proteínas estudadas até agora
(folhas-beta). Isso significa que uma mesma função pode
ser realizada por diferentes estruturas proteicas.
Estrutura do
poro da AQP1 e o mecanismo de passagem da água
Vamos agora estudar um monômero em separado.
| carregar um monômero |
| "abrir" o monômero |
Quatro moléculas de água (representadas apenas por seus
átomos
de oxigênio)
se encontram no canal.
Note que o interior do canal (parede ao redor das moléculas de
água)
é bastante hidrofóbico.
| colorir aminoácidos hidrofóbicos |
Com exceção de uma fileira de aminoácidos no
interior
do canal (aminoácidos na hélice em
roxo), o resto
é todo hidrofóbico.
Os poucos aminoácidos polares permitem a passagem da água
(através do estabelecimento de pontes de hidrogênio
durante a passagem) nesse meio tão hidrofóbico. Em
contrapartida, a alta
hidrofobicidade
do canal impede que a água interaja (muito) com as paredes, o
que
tornaria a passagem da molécula demasiadamente lenta.
Mecanismo de seletividade do canal
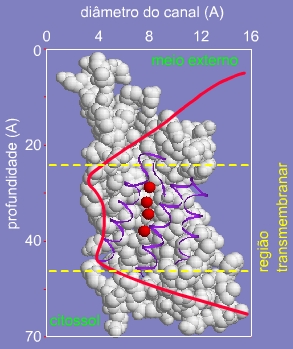
Veja também que o diâmetro do canal diminui das extremidades para o centro, como um funil.

Gráfico 1 -
Variação do diâmetro do canal de passagem de
água.
O diâmetro do poro é drasticamente reduzido na entrada do canal, impondo um limite físico ao tamanho das moléculas que podem passar.
No entanto, uma molécula de água não se encontra
totalmente
isolada, lembre-se que ela faz pontes de hidrogênio com outras
moléculas
de água. Para passar pelo poro é necessário que
essas
outras moléculas de água sejam removidas.
O que ocorre na
aquaporina é que aminoácidos polares dentro do poro
interagem
com essas moléculas, "arrancando-as" da
molécula
de água que irá passar pelo canal.
Os aminoácidos responsáveis por esta retirada de
moléculas
de água ligadas à molécula em passagem na região de
constrição logo na entrada do
canal, são
a histidina 182
e a arginina 197.
| colorir histidina 182 e arginina 197 |
Outros aminoácidos (glicina 190, cisteína 191 e glicina
192)
também participam da formação do anel que retira
moléculas
de água.
Note o anel formado em volta da molécula de água mais
próxima
da face extracelular.
| mostrar outros aminoácidos |
Vamos "apagar" o resto da proteína para visualizar melhor o anel
hidrofílico.
| ver anel hidrofílico |
Rotacione a
molécula para verificar como o
anel constitui a seletiva abertura do canal.
Assim, o anel hidrofílico que arranca moléculas de
água
ligadas à molécula em passagem e a variação
do diâmetro do poro são responsáveis pela
seleção
de moléculas que podem passar, permitindo uma passagem
eficaz através da membrana.
E por que outros íons não passam pelo canal?
Íons positivos sofrem repulsão de aminoácidos
positivos dentro do canal, como a arginina
197 e outros dipostos nas
vizinhaças
do anel.
Da mesma forma, íons negativos sofrem repulsão de
aminoácidos
negativos.