QBQ-211
BIOQUÍMICA: ESTRUTURA
DE BIOMOLÉCULAS E METABOLISMO
WLADIA VIVIANI, Coordenadora
3818-3810 r.215
SHAKER CHUCK
FARAH
3818-3312
r.104
chsfarah@quim.iq.usp.br
ADELAIDE FALJONI-ALÁRIO
3818-3810 r.243
2001
CRONOGRAMA
informações importantes
O
programa de QBQ-211 - "Bioquímica: Estrutura de Biomoléculas
e Metabolismo" - será desenvolvido basicamente por meio de aulas
teóricas, seminários e exercícios. Existem na Biblioteca
do Conjunto das Químicas, à disposição dos
alunos, fitas de vídeo gravadas que tratam de vários tópicos
a serem estudados. No setor de Empréstimo da Biblioteca, o aluno
inscrito, pode requisitar a fita e ver o vídeo na própria
Biblioteca que conta com televisor e aparelho de vídeo cassete numa
pequena sala com capacidade para uns dez ouvintes. Para usufruir deste
recurso didático, bem como para retirar livros, é necessário
que o aluno faça sua inscrição na Biblioteca. Para
isto, o estudante deve comparecer à Biblioteca munido de comprovante
de matrícula, RG original e comprovante de residência.
Geralmente
as primeiras duas horas de um período são reservadas às
aulas teóricas seguidas de um pequeno intervalo. As duas últimas
horas do período são dedicadas aos seminários e exercícios.
Nesse período os alunos irão estudar a matéria por
meio da resolução de exercícios ou da discussão
de tópicos ministrados em aula teórica. Haverá seis
PROVINHAS COLETIVAS (A,B,C,D,E,F,). Essas provas ajudarão na nota
final. Grupos de 04 a 05 estudantes reunem-se na sala de aula de acordo
com suas preferências e respondem coletivamente às perguntas
formuladas. O aluno ausente receberá nota ZERO.
As
aulas práticas visam consolidar e esclarecer melhor os conceitos
discutidos em aulas teóricas e de exercícios. Espera-se muito
empenho dos estudantes durante as aulas de laboratório, além
de muito cuidado e atenção em relação as operações
aí executadas. Existem riscosdeacidentes
esócommuitocuidado
e atenção
é possívelevitá-los.
É
IMPRESCINDÍVEL O USO DE AVENTAL DE ALGODÃO E ÓCULOS
DE SEGURANÇA PRÓPRIOS. O estudante deve entrar no laboratório
pontualmente na hora marcada. Não serão tolerados atrasos,
haja visto que os retardatários prejudicam a si próprios
e aos seus grupos. Alunos que não compareceram nos laboratórios
receberão uma nota de zero.
avaliação
e critério de aprovação
(a)
Avaliação
O
estudante será avaliado no que se refere à assimilação
e ao conhecimento dos tópicos discutidos em aulas teóricas,
seminários, exercícios e laboratórios. A avaliação
será feita por meio de duas provas escritas (1,2), cujos pesos são
7.5 total. O peso total das PROVINHAS COLETIVAS (A,B,C,D,E,F) será
1.5 (0.33 cada). O peso do laboratório será 1.0.
(b)
Critério de Aprovação
Será
aprovado o estudante que obtiver média final igual ou superior
a 5,0 e freqüência mínima de 70%. NÃO HAVERÁ
PROVA SUBSTITUTIVA. Uma prova de recuperação será
oferecida somente para alunos com nota igual ou superior a 3,0.
LIVROS
Na
disciplina “Bioquímica: Estrutura de Biomoléculas e Metabolismo”
(QBQ-211), usam-se vários livros. Assim, por exemplo, um determinado
assunto referente a uma determinada aula teórica ou de exercício
tem sua apresentação baseada em um certo livro, enquanto
o assunto seguinte no calendário pode ter sua apresentação
baseada em um livro diferente. Assim é na Universidade. Não
obstante qualquer livro traz os tópicos discutidos bem como os de
Biologia Molecular, objeto da disciplina QBQ-212. Por isso, é sempre
recomendável ter um livro atualizado, última edição,
de Bioquímica. Saber inglês ajuda muito.
Outra
recomendação útil é a de se utilizar a Biblioteca
do Conjunto das Químicas. Ela se situa na Avenida Lineu Prestes
um pouco acima do Instituto de Química e possui uma grande variedade
de livros didáticos de Bioquímica, contendo vários
exemplares do mesmo título. Ao freqüentar a Biblioteca os alunos
passam a conhecer os diferentes textos e têm maiores condições
de decidir a respeito da compra de um ou outro livro.
A
seguir será feita uma breve análise dos principais textos
didáticos de Bioquímica.
Talvez
o livro didático mais moderno seja o livro do Stryer o Biochemistry.
É uma obra que está na 4a edição,
lançada em 1995. Há tradução para o português
desta 4a edição. É um livro muito
completo e com muitas informações, ideal para consulta. A
3a edição do Stryer (1988) apresenta
uma disposição de capítulos diferente, em relação
à 4a edição. Há também
tradução para o português desta 3a
edição. O Stryer 3a edição
é tão utilizável quanto a 4a edição.
Um
autor muito conhecido pelos estudantes de Bioquímica é o
Lehninger.
O Lehninger é autor de dois textos de Bioquímica diferentes,
o Biochemistry e o Principles of Biochemistry. O primeiro, o Biochemistry,
chegou até a 2a edição (1975) e
foi traduzido para o português. A obra traduzida foi dividida em
quatro fascículos, um para cada parte da matéria: Estrutura,
Catabolismo, Anabolismo e Biologia Molecular. Esse livro, atualmente, tem
utilidade apenas no que se refere à parte de Estrutura, magistralmente
apresentada na obra. Foi um livro, que pela clareza da apresentação,
levou muitos estudantes a se interessarem por Bioquímica na Graduação,
conduzindo mais tarde muitos à Pós-Graduação
e à Pesquisa em Bioquímica. De fato a obra na época,
por ocasião do seu aparecimmento foi muito bem recebida. Alguns
anos depois, Lehninger preferiu escrever um outro livro de Bioquímica,
em vez de lançar a 3a edição do
Biochemistry. Assim em 1982 Lehninger lançou o Principles
of Biochemistry, um texto mais resumido. Há tradução
para o português deste livro. Com seu falecimento em 1986, o Principles
of Biochemistry ficou sem nova edição até que em 1993
dois outros autores seguidores do Lehninger atualizam o Principles
of Biochemistry e publicaram o que seria a 2a edição.
A referência completa desta 2a edição
é:
Lehninger,
Nelson
e Cox, Principles of Biochemistry 2a edição,
1993. Também há tradução para o português
desta 2a edição.
Outros
livros merecem ser apresentados:
Campbell,
Biochemistry, 2a edição, 1995. É
um livro conciso e será utilizado no estudo de Estrutura de Proteínas.
Não existe tradução desta obra para o português.
Marzzoco
e Torres, Bioquímica Básica, 1990. Obra escrita por
autores ligados ao Departamento de Bioquímica do Instituto de Química
da USP. Torres é professor deste Instituto. O texto cobre
muito bem a parte de Metabolismo. É valioso na parte de Integração
Metabólica. Traz uma excelente lista de exercícios.
Conn,
Stumpf, Bruening
e Doi, Outlines of Biochemistry, 5a edição,
1987. Foi um dos
primeiros livros modernos a aparecer no mercado. Até a 4a
edição os únicos autores eram Conn e
Stumpf,
e foi um texto bastante utilizado. Hoje perdeu a aceitação.
Até a 4a edição está traduzido
para o português. Este livro apresenta muito bem o tópico
pH e Tampões e as aulas sobre este assunto serão baseados
nesta obra.
Murray,
Granner, Mayes e
Rodwell,
Harper’s Biochemistry, 33a edição,
1993. É um
livro que mereceu por parte de seguidores do Harper o mesmo tratamento
que recebeu o Principles of Biochemistry do Lehninger. É
um texto totalmente reescrito em relação as primeiras edições
cujo autor principal era o Harper (está na 33a
edição) e sobrevive graças a preferência dada
a ele pelos candidatos dos Estados Unidos a uma espécie de exame
nacional de residência médica. Há tradução
para o português.
Rawn,
Biochemistry, 1989. Parece que este texto teve só esta edição.
É um livro completo, bem escrito, com ilustrações
preciosas e esclarecedoras. As ilustrações apresentam uma
inovação: podem ser vistas em 3D com auxílio de óculos
especiais. O autor chama estas figuras de stereovídeo. Procurem
este livro na Biblioteca.
Voet
e Voet, Biochemistry, 2a edição,
1995. É um texto avançado com belas ilustrações,
muitas delas tornadas transparências que poderão ser apresentadas
durante as aulas.
APOSTILA DE EXERCÍCIOS
pH e SISTEMAS
TAMPÃO
1.
O Ka do ácido fraco HA é 1,6 x 10-6. Calcular:
a)
O grau de ionização do ácido para uma solução
10-3 M
b)
O pH
2.
Calcular os valores apropriados e traçar a curva de titulação
(pH versus Volume de titulante adicionado) de 500 ml de um ácido
fraco HA 0,1 M com KOH 0,1 M; Ka = 10-5 (pKa = 5,0).
3.
Quais os fatores que determinam a eficiência ou capacidade tamponante
de uma solução?
4.
Dispõe-se de solução de ácido acético
e acetato de sódio ambas 0,1 M. Com estas duas soluções,
descrever a preparação dos seguintes tampões acetato
0,1 M (pKa do ácido acético = 4,7):
a)
pH = 3,7
b)
pH = 5,7
5.
Esquematizara curva de titulação
do ácido fosfórico. Quantos e quais são os sistemas
tampão observados na titulação de todos os hidrogênios
ionizáveis das moléculas de ácido fosfórico?
Dados:
pKa1 = 2,1; pKa2 = 7,2 e pKa3 = 12,3.
6.
Calcular a relação [HCO3-]/[H2CO3]
no plasma sanguíneo em pH 7,4
(pKa = 3,77),
b)
Calcular a relação [HPO42-]/[H2PO4-]
no plasma sanguíneo (pKa = 7,20),
c)
Qual dos dois pares ácido-base conjugados é o tampão
mais eficiente em uma amostra de plasma sanguíneo em um frasco fechado,
sem espaço disponível para gases (totalmente ocupado por
líquido)?
7.
O plasma sanguíneo contém uma reserva ("pool") total de carbonato
(essencialmente HCO3- + CO2) de 2,52 x
10-2M.
a)
Qual é a razão [HCO3-]/[CO2]
e a concentração de cada componente do tampão presente
a pH 7,4?
b)
Qual seria o pH se for adicionado 10-2 M de H+ sob
condições tais que o aumento da [CO2] não
possa ser liberado?
c)
Qual seria o pH se for adicionado 10-2 M de H+ e
o excesso de CO2 eliminado (mantendo-se assim a [CO2]
original)?
Considerar o pKa para o equilíbrio abaixo:
CO2
+ H2OÛHCO3-
+ H+, como sendo 6,1.
AMINOÁCIDOS
1.
a) Escreva a estrutura química de cada aminoácido em pH 7,0
b)
Escreva as estruturas das várias formas iônicas de alanina,
ácido aspártico e lisina que podem existir entre pH 1 e pH
14. Mostre como cada forma ioniza em água.
2.
Desenhe a curva de titulação da alanina, do ácido
aspártico e lisina. Indique o pI de cada.
3.
Quais são as mobilidades eletroforéticas relativas de glicina,
leucina, ácido aspártico, ácido glutâmico e
lisina a pH 4,7?
Dados:
|
|
Aminoácido
|
|
|
|
|
Lisina
|
|
|
|
|
Glicina
|
|
|
|
|
Leucina
|
|
|
|
|
Ácido
Glutâmico
|
|
|
|
|
Ácido
Aspártico
|
|
|
Considere
a mobilidade eletroforética como sendo diretamente proporcional
a ![]()
4.
Relação entre estrutura epropriedades
químicas dos aminoácidos.
Uma
vez que os aminoácidos servem como unidades fundamentais formadoras
das proteínas, o conhecimento de suas estruturas e propriedades
químicas é crucial para a compreensão de como as proteínas
executam suas funções biológicas.
a)
Escreva as estruturas das cadeias laterais (grupos R) dos seguintes aminoácidos:
(1) Ala, (2) Arg, (3) Asn, (4) Asp, (5) Cys, (6) Glu, (7) Gly, (8) His,
(9) Lys, (10) Met, (11) Phe, (12) Pro, (13) Ser, (14) Trp, (15) Tyr e (16)
Val.
b)
Associe compatibilizando cada estrutura com a descrição de
suas propriedades fornecidas abaixo (algumas descrições podem
servir a mais de uma estrutura).
(Associe
o número do aminoácido com a letra correspondente à
descrição).
a)
Grupo R pequeno e polar contendo um grupo hidroxila. Este aminoácido
é importante no sítio ativo de algumas enzimas.
b)
Provoca o menor impedimento estérico.
c)
O grupo R tem pKa próximo de 10,5, o que torna-o carregado positivamente
no pH celular.
d)
O grupo R contém enxofre e é neutro em todos os pHs.
e)
O grupo R é aromático, de natureza hidrofóbica e neutro
em todos os pHs.
f)
O grupo R é derivado de hidrocarboneto saturado, importante em interações
hidrofóbicas.
g)
O único aminoácido que possui um grupo R ionizável
com pKa próximo de 7. É um grupo importante no sítio
ativo de algumas enzimas.
h)
O único aminoácido que possui um a-amino
grupo substituído. Influencia o dobramento da proteína forçando
uma curvatura na cadeia.
i)
O grupo R tem pKa próximo de 4 e assim está carregado negativamente
em pH 7.
j)
Tem grupo R aromático, capaz de formar pontes de hidrogênio;
tem pKa perto de 10.
k)
Forma ligações cruzadas de dissulfeto (pontes de dissulfeto)
entre cadeias polipeptídicas, o pKa do seu grupo funcional é
cerca de 8.
l)
O grupo R tem pKa próximo de 12, fazendo-o positivamente carregado
em todos os pHs fisiológicos. Sua carga positiva é importante
em algumas proteínas para a ligação com grupos fosfatos
negativamente carregados.
m)
Quando seu grupo R polar não carregado é hidrolisado, este
aminoácido converte-se emoutro
que possui uma carga negativa em seu grupo R quando em pH ao redor de 7
PEPTÍDEOS
E PROTEÍNAS
1.Desenhe
uma reação de formação de uma ligação
peptidica e explique as principais caracteristicas da ligação.
2.
Para o tripeptídeo H3N+-Ala-Lys-Ser-COO-
a)
Classifique os grupos R segundo suas polaridades.
b)
Diga para que tipo de ligação esses grupos poderiam contribuir
na estrutura terciária de uma proteína.
c)
Calcule o pI sabendo que:
|
|
|
|
|
|
|
|
|
pKa1
|
|
|
|
|
|
|
pKa2
|
|
|
|
|
|
|
pKa3
(grupo R)
|
|
|
|
|
d)
Para que polo migraria o tripeptídeo numa eletroforese feita a pH
= 7?
e)
Discuta a capacidade do peptídeo de atuar como tampão.
f)
Refaça os ítens anteriores para um tripeptídeo contendo
ácido glutâmico no lugar de lisina.
3.
Indique se as seguintes afirmações são falsas ou verdadeiras.
Justifique.
a)
Pontes de hidrogênio ocorrem entre átomos de hidrogênio
na superfície das moléculas de proteína em solução.
b)
A conformação termodinamicamente mais estável de uma
proteína corresponde a estrutura de energia livre mais baixa.
c)
A formação de pontes de hidrogênio internas corresponde
a principal interação que direciona o dobramento da molécula
de proteína.
d)
Solventes orgânicos desnaturam proteínas, principalmente por
dificultar interações iônicas.
e)
O dobramento de uma molécula de proteína hidrofóbica
é acompanhado por um aumento na entropia do polipeptídeo.
f)
O termo estrutura quaternária refere-se a conformação
da proteína em quarta dimensão, isto é, como uma função
do tempo.
g)
Pontes dissulfeto ligam covalentemente resíduos de cisteína
cujas proximidades são determinadas por interações
prévias não covalentes.
h)
Numa a-hélice,
os hidrogênios amídicos de todas as ligações
peptídicas estão formando pontes de hidrogênio.
i)
A partir da estrutura primária completa de uma proteína,
é possível predizer sua conformação tridimensional.
4.
Seguindo as instruções abaixo, faça com papel um modelo
aproximado de uma a-hélice:
a)
Trace em papel milimetrado duas linhas paralelas separadas 1,8 cm uma da
outra.
b)
Na linha de baixo, a partir de origem marque pontos distantes 3 cm um do
outro.
c)
Na linha superior marque a origem 0,5 cm à frente da origem correspondente
na linha inferior. A partir da origem, marque pontos na linha superior
distantes 3 cm um do outro.
d)
Una os pontos correspondentes nas linhas superior e inferior, de tal modo
a obter uma série de paralelogramos.
e)
Em cada paralelogramo trace três segmentos auxiliares:
(1)
No lado menor da esquerda marque um ponto 0,3 cm abaixo do vértice
esquerdo superior. No lado menor à direita marque um ponto 0,3 cm
acima do vértice inferior. Una estes pontos.
(2)
e (3) Trace segmentos paralelos aos lados menores que distem entre si 1
cm. Desta forma o paralelogramo é dividido por estes segmentos em
três terços iguais.
f)Escreva
a letra C (carbono) no encontro dos segmentos (1) e (2) e o N (nitrogênio)
no encontro de (1) e (3).
g)
No centro dos lados menores escreva Ca.
h)
Una C a
- C - N - C a
- C - N - ....
i)Faça
C = O para cima ao longo do segmento (2) e N - H para baixo ao longo de
(3).
j)Dobre
a tira de papel nas posições correspondentes aos lados menores
e fixe as pontes de hidrogênio N - H ... O = C com pequeno
pedaço de fita adesiva, de tal forma a obter no conjunto uma hélice.
5.
Seguindo as instruções abaixo, faça com papel um modelo
aproximado de um folha pregueada b
com cadeias polipeptídicas antiparalelas:
a)
Numa folha de papel sulfite com seus lados maiores em posição
horizontal trace as linhas auxiliares da maneira indicada abaixo.
b)
Trace levemente linhas verticais distantes entre si 6 cm. A primeira linha
à esquerda pode distar 1 cm do lado menor.
c)
Trace levemente pares de paralelas horizontais distantes 1,2 cm entre si.
No primeiro par, a linha superior deve distar 1 cm do lado maior superior
da folha de papel. A paralela inferior dista 1,2 cm da linha superior.
d)
Abaixo 4,2 cm da linha inferior do primeiro par de paralelas trace a linha
superior do segundo par. Trace em seguida a linha inferior do segundo par.
e)
Da mesma forma trace o terceiro e quarto pares de paralelas.
f)
Com asverticais e os pares de paralelasvocê
obteve umasérie de retângulos
medindo 1,2 cm (lado menor) por 6 cm (lado maior).
g)
Na primeira série de retângulos (a série superior)
escreva Ca
no vértice superior esquerdo do primeiro retângulo da esquerda.
No vértice inferior direito escreva também Ca.
Assim, de forma diagonalmente oposta, vá escrevendo Ca
na primeira série de retângulos.
h)
Na segunda série de retângulos (uma abaixo da série
superior) escreva Ca
no vértice inferior esquerdo do primeiro retângulo da esquerda.
No vértice superior direito escreva também Ca.
Assim, de forma diagonalmente oposta, vá escrevendo Ca
na segunda série de retângulos.
i)Proceda
com em (g) para escrever Ca
na terceira série de retângulos.
j)Proceda
como em (h) para escrever Ca
na quarta série de retângulos.
k)
Entre 2 verticais (separadas de 6 cm) trace levemente 2 outras verticais
separadas de 2 cm.
l)
Agora, na primeira série de retângulos escreva C de forma
diagonalmente aposta a Ca.
Diagonalmente oposto a C escreva N. Vá escrevendo C e N diagonalmente
opostos.
m)
Também, na segunda série de retângulos escreva N de
forma diagonalmente oposta a Ca.
Diagonalmente oposto a N escreva C. Vá escrevendo N e C diagonalmente
opostos.
n)Na
terceira série de retângulos escreva C e N como em (l).
o) Na
quarta série de retângulos escreva N e C como em (m).
p)Nos
C (não em Ca)
façaC=O(as
ligações devem estar centradas em C e a 120o).
q)Nos
N façaN-H(as
ligações devem estar centradas em N e a 120o).
r)Estabeleça
as pontes de hidrogênio entre as cadeias com osC=OeN-Hpróximos
(C = O --- H - N).
s)
Dobre a folha de papel em zig-zag, vincando-a nas verticais que passam
por Ca.
6.
Dado o polipeptideo abaixo, onde ocorreria com maior probabilidade a formação
de uma alça ou mudança de direção? Justifique.
Onde ocorreria uma ponte dissulfeto?
Ile-Ala-His-Thr-Tyr-Gly-Pro-Phe-Glu-Ala-Ala-Met-Cys-Lys-Trp-Glu-Ala-Gln-Pro-Asp-Gly-Met-Glu-Cys-Ala-Phe-His-Arg.
7.
Indicar a provável localização (interior ou exterior)
dos seguintes aminoácidos em uma proteína globular: Asp,
Leu, Ser, Val, Gln, Lys, Cys, Ala. Justifique.
ANÁLISE
DE PROTEÍNAS
|
|
CNBr
(brometo de cianogênio)
|
Cloreto
de Dansila
|
|
|
Uréia
|
HCl
6N
|
|
|
b-Mercaptoetanol
|
Ninhidrina
|
|
|
Tripsina
|
Fenil
isotiocianato
|
|
|
Ácido
Perfórmico
|
Quimiotripsina
|
Qual(is)
dele(s) é(são) o(s) mais adequado(s) para executar cada uma
das seguintes tarefas?
a)
Determinação da sequência de aminoácidos de
um peptídeo pequeno.
b)
Identificação de um resíduo amino-terminal de um peptídeo
(do qual dispõe-se somente de menos de 10-7 g).
c)
Desnaturação reversível de uma proteína isenta
de pontes de dissulfeto. Que outro reagente seria necessário se
elas estivessem presentes?
d)
Hidrólise de ligações peptídicas no lado carboxílico
de resíduos com R aromático.
e)
Clivagem de ligações peptídicas no lado carboxílico
de metioninas.
f)Hidrólise
de ligações peptídicas no lado carboxílico
de resíduos de lisina e arginina
2.
Indique as propriedades das proteínas nas quais se baseiam as seguintes
técnicas utilizadas na sua purificação:
(a)Eletroforese,
(b) Salting out, (c) Precipitação no pI, (d) Ultracentrifugação
e (e) Diálise
(f)
Cromatografia de troca iônica (g) Cromatografia por afinidade
3.
Em que pH será aeletroforese
mais eficiente na separação das seguintes misturas de proteínas?
a)
Albumina sérica e hemoglobina; pIs=4,9e6,8,
respectivamente
b)
Mioglobina e quimiotripsinogênio; pIs = 7,0 e 9,5, respectivamente
c)
Albumina do ovo, albumina sérica e urease, pIs = 4,6 ,4,9e5,0,
respectivamente
4. Abaixo
está representada a mobilidade eletroforética em pH 8,6 da
hemoglobina normal e de uma série de hemoglobinas anormais (que
possuem um aminoácido substituído):
(-)ÄÄÄÄÄÄÁÄÄÄÄÄÁÄÄÄÄÄÄÄÄÄÄÄÁÄÄÄÄÄÄÄÄÄÄÄÄÁÄÄÄÄÄÁÄÄÄÄ
(+)
ABNormalCD
Indique
a que posição A, B, C ou D corresponde cada hemoglobina anormal:
HbS
-
Val em lugar de Glu, HbJ - Asp em lugar de Gly, HbN - Glu
em lugar de Lys e HbC -
Lys
em lugar de ácido Glu.
5. Um
método utilizado para purificação de proteínas
utiliza a solubilidade difrencial das proteínas. Sabe-se que a solubilidade
de grandes cadeias polipeptidicas possue uma alta dependência do
número de resíduos polares, principalmente de cadeias ionizaveis:
quanto mais ionizável mais solúvel. Tendo em vista esta afirmação
quais das cadeias abaixo seriam mais soluveis:
a-(Gly)20
ou (Glu)20 em pH7.0
b-(Lys-Ala)3
ou
(Phe-Met)3 em pH
7.0
c-(Ala-Ser-Gly)5
ou (Asn-Ser-His)5 em pH 6.0
d-(Ala-Asp-Gly)5
ou (Asn-Ser-His)5 em pH 3.0
ENZIMAS
1.
Definir: Enzima, sitio catalitico, cofator, coenzima, grupo prostetico
e vitamina.
2.
. Um extrato bruto livre de células contém 20 mg/ml de proteína.
Uma alíquota de 10 ml
(microlitros) deste extrato em um volume total de reação
standard de 0,5 ml catalisou a formação de 30 nmoles (nanomoles)
do produto em 1 min sob condições ótimas de ensaio
(força iônica e pH ótimos, concentrações
saturantes de todos substratos, coenzimas, ativadores, etc.)
a)
Expressevemtermos
denmoles x ml-1 x min-1,nmoles
x litro-1 x min-1,mmoles
x litro -1 x min-1eM
x min-1 .
b)
Qual seria o valor de v se os mesmos 10 ml
do extrato fossem ensaiados em um volume total de 1,0 ml?
c)
Em termos de unidades/ml, qual é a concentração da
enzima na mistura de ensaio e no extrato?
d)
Qual é a atividade específica da preparação?
2.
A acetilcolinesterase (uma esterase) catalisa a hidrólise da acetilcolina:
acetilcolina+H2O ®
colina+ácido
acético
a)
Escreva a reação catalisada usando fórmulas estruturais
e indique na estrutura da acetilcolina a ligação que é
clivada.
A
enzima é inativada por DFP (diisopropilfluoro-fosfato).
b)
Qual é o resíduo de aminoácido que provavelmente está
no sítio ativo da esterase?
c)
Como poderia ser identificado o resíduo modificado?
d)
Qual é o provável papel deste resíduo no mecanismo
da catálise?
3.
(Resolver
numericamente; não graficamente). Os dados da tabela abaixo
foram obtidos para uma reação enzimática (volume final
10 ml), usando-se o seguinte procedimento:
A
fim de se estudar a dependência da velocidade de uma reação
enzimática pela concentração de substrato, uma quantidade
constante de enzima foi adicionada a uma série de tubos contendo
diferentes concentrações de substrato. As velocidades iniciais
da reação foram determinadas medindo-se o número de
moles (ou mmoles)
de substrato consumido (ou produto formado) por minuto. A tabela a seguir
mostra as velocidades iniciais fornecidas pelas respectivas concentrações
de substrato:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Pergunta-se:
(a)
Qual é a Vmax para esta concentração de
enzima?
(b)
Qual é o KM desta enzima?
(c)
Verifique se esta reação segue uma cinética simples
de Michaelis-Menten.
(d)
Quais serão as velocidades iniciais para:
[S]
= 1,0 x 10-6 Me [S] =
1,0 x 10-1 M?
(e) Calcule
a quantidade total de produto formado durante os primeiros cinco minutos
quando a
[S] = 2,0 x 10-3 M. É possível fazer o mesmo cálculo
para uma
[S]=2,0x10-6
M?
(f)
Suponha que a concentração de enzima em cada tubo foi aumentada
por um fator de 4. Quais são os valores de KM e Vmax?
Neste caso, qual é o valor de v para
[S]
= 5,0x10-6 M?
4.
A penicilinase, uma enzima presente em algumas bactérias resistentes,
hidrolisa penicilina tornando-a inativa. O P.M. desta enzima em Staphylococcus
aureus é 29.600. Mediu-se em função da concentração
de penicilina, a quantidade deste antibiótico que foi hidrolisada
em 1 minem 10 ml de uma solução
que continha 10-9 g de penicilinase purificada. Considere que
a concentração de penicilina não se altera apreciavelmente
durante o ensaio:
|
|
(moles/litro) |
(moles) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(b)
Qual é o valor de Vmax?
(c)
Qual é o valor do número de transformação (turnover)da
penicilinase nestas condições experimentais? (Considere um
centro ativo por molécula de enzima)
5.
Faça o gráfico da velocidade de uma reação
enzimática em função do pH, admitindo-se que a enzima
seja estável de pH 3 a 12, o substrato não contém
grupos ionizáveis e a catálise depende da presença
no centro ativo de: (a) uma carboxila (pKa = 5) desprotonada, (b) um grupo
amina (pKa = 9) protonado, e (c) uma carboxila (pKa = 5) desprotonada e
um grupo amina (pKa = 9) protonado.
6.
Exercicios 4,5, 6, 7 paginas 221 e 222 do Marzzoco e Torres, Bioquímica
Básica
7.
Foram efetuadas medidas cinéticas para uma enzima na ausência
e na presença de inibidor ([I] = 2 x 10-3 M, fixa). As
velocidades iniciais correspondentes às várias concentrações
de substrato estão indicadas na tabela abaixo:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(b)
Qual é o tipo de inibição?
(b)Qual
é o valor da constante de dissociação do complexo
enzima-inibidor? Compare com o valor de KM.
8.
Foram efetuadas medidas cinéticas paraaenzimadiscutida
noexercícioanteriornapresençade
um inibidordiferente([I]
= 10-4
M, fixa):
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(a)
Quais são os valores de Vmaxe
KM na presença deste inibidor?
(b)
Qual é o tipo de inibição?
(c)
Qual é o valor da constante de dissociação do complexo
enzima-inibidor?
9.
Qual a diferença básica entre inibidor competivo e não
competitivo. Como podemos distinguir o tipo de inibição em
um ensaio enzimático?
10. Exercícios
8, 9,11 e 12 do Marzzoco e Torres, Bioquímica Básica
HEMOGLOBINA
1.
a) Distinguir
entre alosteria e cooperatividade.
b) Descrever
a cooperatividade de ligação de oxigênio a hemoglobina.
c) Oxigênio
liga-se a mioglobina com cooperatividade? Explique.
d)Quais
são os efetuadores alostericos com relevância fisiológica
para a ligação de oxigênio a hemoglobina.
2.
Lehninger,
Principles of Biochemistry, Capítulo 8, Problema 9. Comparação
entre as hemoglobinas da mãe e do feto. Estudo do transporte
de oxigênio em mulheres grávidas mostraram que as curvas de
saturação pelo oxigênio do sangue materno e fetal são
marcadamente diferentes quando medidas nas mesmas condições.
Esta observação provém do fato de os eritrócitos
fetais possuirem uma variante natural da hemoglobina A (a hemoglobina F, a2g2),
enquanto que os eritrócitos maternos contém a hemoglobina
A (a2b2),
normal em adultos.
a)
Qual das hemoglobinas apresenta maior afinidade pelo oxigênio nas
condições fisiológicas? Explique.
b)
Qual é o significado fisiológico das diferenças de
afinidade? Explique.
Removendo-se cuidadosamente todo DPG de amostras de hemoglobina A e F, verifica-se que as curvas de saturação pelo oxigênio (e consequentemente as afinidades) são deslocadas, no gráfico, para o lado esquerdo. Nesta situação, hemoglobina A passa a ter maior afinidade pelo oxigênio. Recolocando-se DPG, as curvas de saturação voltam ao normal, como mostrado no gráfico acima.Pergunta-se:
c)
Qual é o efeito de DPG na afinidade da hemoglobina pelo oxigênio?
d)
Como as informações acima (relativas ao item c) podem explicar
a razão das diferentes afinidades apresentadas pela hemoglobina
fetal e materna?
LIPÍDEOS
e MEMBRANAS
1.
Lehninger,
Princípios de Bioquímica, Capítulo 12, Problema 1.
Ponto de fusão dos ácidos graxos. Os pontos de fusão
de uma série de ácidos graxos de 18 átomos de carbono
são: ácido esteárico (69,9oC), ácido
oléico (13,4oC), ácido linoléico(-5oC)
e ácido linolénico (-11oC). Que aspecto estrutural
destes ácidos graxos de 18 carbonos pode ser correlacionado com
o ponto de fusão? Forneça uma explicação molecular
para esta tendência do ponto de fusão.
2.
Lehninger,
Princípios de Bioquímica, Capítulo 12, Problema 13.
Fluidez e função da membrana. Uma hipótese central
na pesquisa de membranas é que os lipídeos da membrana devem
ser fluídos (em oposição a "congelados") a fim de
que a membrana possa desempenhar suas funções. O apoio para
esta hipótese é fornecido pela observação de
que a composição de ácido graxo das membranas pode
ser alterada pelas condições nas quais a bactéria
cresce. Por exemplo, se a bactéria está crescendo em temperatura
menor que a normal, as quantidades observadas de ácidos graxos insaturados
(relativas ao conteúdo de ácido graxo saturado) estão
acima do normal.
Contrariamente,
se a bactéria está crescendo em temperatura acima da normal,
as quantidades observadas de ácidos graxos insaturados nos lipídeos
da membrana (relativas aos ácidos graxos saturados) estão
abaixo do normal.
(a)
Sugira razões para o fato de que o conteúdo lipídico
na membrana bacteriana deve ser fluido para que a membrana intacta opere
apropriadamente.
(b)
Explique como a alteração observada nos níveis dos
ácidos graxos insaturados relativa aos níveis dos ácidos
graxos saturados, em diferentes temperaturas de crescimento, apóia
a hipótese da fluidez da membrana.
3.
Stryer,
Biochemistry, 2a. ed., Capítulo 10, Problema 1 Quantas moléculas
de fosfolipídeo existem em 1mm2
da região da membrana em bicamada de fosfolipídeo? Considere
que a molécula de fosfolipídeo ocupa 70 Å2
de área.
4.
Rawn,
Biochemistry, Capitulo 9, Problema 3. Qual é a força
("driving force")que dirige a formação
de bicamadas fosfolipídicas?
5.
Lehninger,
Principles of Biochemistry, Capítulo 4, Problema 9. O pH e a absorção
de drogas. A droga aspirina, intensamente receitada, é um ácido
fraco com um pKa de 3,5. A aspirina é absorvida para o sangue através
das células de revestimento do estômago e do intestino delgado.
Para uma substância ser absorvida ela deve atravessar facilmente
a membrana celular. A passagem através da membrana celular é
determinada pela polaridade da molécula: moléculas iônicas
(carregadas) e moléculas altamente polares passam lentamente, enquanto
aquelas neutras e hidrofóbicas passam rapidamente. Como o pH do
suco gástrico é cerca de 1 e o pH no intestino delgado, cerca
de 6, pergunta-se:
a)
Escreva por fórmulas estruturais a ionização reversível
da aspirina.
b)
Onde a aspirina é mais absorvida para a corrente sanguínea,
no estômago ou no intestino delgado? Justifique claramente a sua
escolha.
6.
Rawn,
Biochemistry, Capítulo 9, Problema 2. Forneça uma explicação
termodinâmica para o fato de que moléculas de fosfolipídeo
difundem rapidamente no plano da bicamada, mas muito lentamente mudam de
uma face à oposta.
7.
Stryer,
Biochemistry, 3a. ed., Capítulo 12, Problema 5.R.D.
Kornberg e H.M. McConnell (1971) pesquisaram a difusão transversa
(flip-flop) de fosfolipídeos em uma membrana em bicamada usando
um análogo paramagnético da fosfatidilcolina chamado fosfatidilcolina
marcada com marcador de spin. (Procure a fórmula estrutural deste
marcador de spin no Stryer).
O
grupo nitróxido (NO) em uma fosfatidilcolina marcada com marcador
de spin fornece um espectro de ressonância eletrônica paramagnética
característico. Este espectro desaparece quando nitróxidos
são transformados em hidroxilaminas por agentes redutores, tal como
o ascorbato.
Vesículas
de lipídeos contendo fosfatidilcolina (95%) e o análogo marcado
(5%) foram preparadas por sonicação e purificadas por cromatografia
de filtração em gel. O diâmetro externo destes lipossomos
mediu cerca de 25Å.
A amplitude do espectro de ressonância eletrônica paramagnética
decresceu a 35% do seu valor inicial em poucos minutos após a adição
de ascorbato. Não houve nenhuma mudança detectável
no espectro poucos minutos após a adição de uma segunda
alíquota de ascorbato. Entretanto, a amplitude do espectro residual
decai exponencialmente com uma meia-vida de 6,5 h.
Como
você interpreta estas mudanças na amplitude do espectro paramagnético?
8.
Campbell,
Biochemistry, 2a ed. Capítulo
15, Problema 15.
Por que, ao invés de na forma livre, o colesterol é transportado
na corrente sanguínea na forma empacotada? (Ler no Campbell,
2a
ed. no Capítulo 8, o tópico "Receptores de Membrana"
e, no Capítulo 15, o tópico "O Papel do Colesterol
em Doenças do Coração". Ler no Stryer, 3a
ed. no Capítulo 23, os tópicos "Colesterol e outros
Lipídeos são transportados a Alvos Específicos por
Lipoproteínas", "O Receptor da Lipoproteína de Baixa Densidade
(LDL) desempenha um papel importante no controle do Metabolismo do Colesterol",
"O Receptor da LDL é uma Proteína Transmembrânica com
cinco domínios funcionalmente diferentes" e "A ausência do
Receptor de LDL leva a Hipercolesterolemia e a Aterosclerose").
9.
Campbell,
Biochemistry, 3a ed. Capítulo
8, Problema 22. Que
tipo de resíduos de aminoácidos é mais provável
se encontrar no sítio de ligação do receptor da LDL?
Dê uma razão para sua resposta.
CARBOIDRATOS
1.
Stryer,
Biochemistry, 3a ed., Capítulo 14, Problema 1. Indique se cada
um dos seguintes pares consiste de anômeros, epímeros ou par
aldose-cetose:
a)
D-gliceraldeido e dihidroxiacetona
b)
D-glicose e D-manose
c)
D-glicose e D-frutose
d) a-D-glicose
e b-D-glicose
e)
D-ribose e D-ribulose
f)
D-galactose e D-glicose
2.
Lehninger,
Principles of Biochemistry, Capítulo 11, Problema 1. Interconversão
das formas de D-galactose.
Uma
solução recém-preparada da forma a
de D-galactose (1g/ml em um tubo polarimétrico de 1 dm) mostra uma
rotação óptica de + 150,7o.Quando
deixada em repouso por um longo período de tempo a rotação
decresce gradualmente até atingir um valor de equilíbrio
igual a + 80,2o. Em contraste, uma solução recém-preparada
(1g/ml) da forma b
mostra rotação ótica de apenas +52,8o .
Quando esta solução é deixada em repouso por várias
horas a rotação aumenta até o valor de equilíbrio
igual a +80,2o , valor idêntico àquele observado
para a a-D-galactose.
a)
Escreva as fórmulas de projeção de Haworth das formas a
e b
da D-galactose. Qual característica distingue as duas formas?
b)
Por que a rotação de uma solução recém-preparada
da forma a
decresce gradualmente com o tempo? Explique por que soluções
das formas a
e b
(de concentrações iguais) atingem o mesmo valor de rotação
óptica no equilíbrio?
c)
Calcule a composição percentual das duas formas de galactose
no equilíbrio.
3.
Van
Eikeren, Guide to Lehninger’s Principles of Biochemistry, Capítulo
11, Structure and Properties of Monosaccharides, Study Questions and Problems,
Problema 7. Frutose,
o principal açúcar do mel, é comumente usada como
adoçante de alimento. Este açúcar na formab-D-piranoseéprovavelmenteasubstânciamais
doceconhecida.Aformab-D-furanose
é muito menos doce.
a)
Quais são as estruturas da b-D-frutopiranose
e b-D-frutofuranose?
b)
A doçura do mel diminui ao deixá-lo em repouso e ao mesmo
tempo aumentando a temperatura. Explique.
4.
Van Eikeren, Guide to Lehninger’s Principles of Biochemistry, Capítulo
11, Covalently Bonded Monosaccharides: Disaccharides and Polysaccharides,
Study Questions and Problems, Problema 1. Conhecendo-se
as fórmulas de projeção de Haworth da maltose, lactose
e sacarose, identifique em cada uma delas a ligação glicosídica.
Quais são os produtos quando cada dissacarídeo é hidrolisado
em presença de ácido? Escreva as estruturas dos monossacarídeos.
5.
Van Eikeren, Guide to Lehninger’s Principles of Biochemistry, Capítulo
11, Covalently Bonded Monosaccharides: Disaccharides and Polysaccharides,
Study Questions and Problems, Problema 2. Uma
amostra de dissacarídeo corresponde ou a lactose ou a sacarose.
A amostra fornece resultado negativo no teste para se verificar se o dissacarídeo
é redutor. Entretanto, o mesmo teste dá resultado positivo
se a amostra é antes tratada com ácido diluído e aquecida.
A amostra desconhecida corresponde a lactose ou a sacarose? Explique.
6.
Lehninger,
Principles of Biochemistry, Capítulo 11, Problema 7. Comparação
entre celulose e glicogênio. A Celulose, praticamente pura obtida
das fibras que envolvem as sementes do algodão, é resistente,
fibrosa e completamente insolúvel em água. Diferentemente,
o glucogênio extraído de fígado ou músculo dispersa-se
facilmente em água quente formando uma solução turva.
Embora eles tenham propriedades físicas marcadamente diferentes,
as duas substâncias são compostas por moléculas de
D-glicose polimerizadas através de ligações 1 ®
4 e têm pesos moleculares comparáveis.
Quais
características estruturais são responsáveis por estas
propriedades tão diferentes dos dois polissacarídeos?
Quais
as vantagens biológicas de suas respectivas propriedades físicas?
7.
Van
Eikeren, Guide to Lehninger’s Principles of Biochemistry, Capítulo
11, Self-Test, Problema 13.A
porção de natureza sacarídica de algumas glicoproteínas
pode servir como sítio de reconhecimento celular. Para desempenhar
esta função, os oligossacarídeos ou glicoproteínas
devem ter a capacidade de formar um grande número de diferentes
estruturas. Qual dos dois pode produzir uma maior variedade de estruturas:
oligopeptídeos compostos de cinco resíduos de diferentes
aminoácidos ou oligossacarídeos compostos de cinco resíduos
de diferentes monossacarídeos? Explique.
8.
Stryer,
Biochemistry, 3a ed. Capítulo
14, Problema 7.
Supõe-se que uma unidade trissacarídica de uma glicoproteína
de uma superfície celular desempenha um papel crítico em
promover a adesão célula-célula em um determinado
tecido. Planeje um experimento simples para testar esta idéia.
TERMODINÂMICA
APLICADA ÀS REAÇÕES BIOQUÍMICAS
1.
Wood
et al., Biochemistry: A Problems Approach,2a
ed., Capítulo 9, Problema 9-4. O DGo’
para a hidrólise do ATP a ADP + Pi é-7,3
kcal/mol.
a)
Calcule a constante de equilíbrio para esta reação.
No equilíbrio há mais ADP que ATP ou o inverso?.
b)
Na célula esta reação está no equilíbrio?
2.
Wood
et al., Biochemistry: A Problems Approach, 2a ed., Capítulo
9, Problema 9-5.No
interior da célula é, em geral, o DG'
para a hidrólise do ATP mais negativo ou menos negativo que o DGo’?
Por quê?
3.
Stryer,
Biochemistry, 3a ed., Capítulo 13, Problema 5. A
formação de Acetil CoA a partir de Acetato é um processo
dependente de ATP:
Acetato + ATP
+ CoAAcetil CoA + AMP + PPi
a)
Calcular oDGo’
da reação acima, sabendo-se que os DGo’
de hidrólise do Acetil CoA a Acetato é -7,5 kcal/mol e do
ATP a AMP e PPi é -7,3 kcal/mol.
b)
Sabendo que nas células o PPi formado é rapidamente hidrolisado
a 2Pi por uma pirofosfatase inorgânica (DGo'=
-8 kcal/mol), discuta o efeito da hidrólise do PPi na formação
de Acetil CoA a partir de Acetato.
4.
Stryer, Biochemistry, 3a ed., Capítulo 13, Problema 4.
Dados os DGo’
de hidrólise de glicose-6-fosfato e glicose-1-fosfato, respectivamente
-3,3 kcal/mol e -5,0 kcal/mol, calcule:
a)
O DGo’
da isomerização de glicose-6-fosfato a glicose-1-fosfato.
b)
Noequilíbrio,qualéarazãoentreasconcentraçõesde
glicose-6-fosfato e de glicose-1-fosfato?
c)
Em que condições celulares a isomerização referida
no item (a) poderia produzir continuamente e em alta velocidade a glicose-1-fosfato?
5.
Stryer,
Biochemsitry, 3a ed., Capítulo 13, Problema 1. Discuta
em que sentido ocorrem as reações abaixo, quando os reagentes
estão presentes inicialmente em quantidades equimolares
a)
ATP + creatina¨creatinafosfato
+ ADP
b)
ATP + glicerol¨glicerol-3-fosfato
+ ADP
c)
ATP + piruvato¨fosfoenolpiruvato
+ ADP
d)
ATP + glicose¨glicose-6-fosfato
+ ADP
DGo’
de hidrólise
creatinafosfato-10,3
kcal/mol
glicerol-3-fosfato-
2,2 kcal/mol
fosfoenolpiruvato-14,8
kcal/mol
glicose-6-fosfato-
3,3 kcal/mol
ATP
a ADP- 7,3 kcal/mol
6.
Van
Eikeren, Guide to Lehninger's Principles of Biochemistry, Capítulo
14, Self-Test, Problema 1. Considere
um ecossistema que consiste de um ovo e uma chocadeira. A clara e a gema
do ovo contêm proteínas, carboidratos e lipídeos. Se
fertilizado, o ovo transforma-se de uma simples célula em um organismo
complexo. Discuta este processo irreversível em termos de variações
de entropia que se verificam no sistema, vizinhanças e universo.
Esteja certo de que, antes de mais nada, você tenha definido claramente
o sistema e as vizinhanças.
COMPOSTOS RICOS EM ENERGIA
São
compostos cuja hidrólise é acompanhada de uma grande queda
de energia livre. Estão incluídos nesta classificação
os compostos cujos DGo’
de hidrólise são, no mínimo, da ordem de -6.500 cal/mol.
Seguem-se exemplos de reações de hidrólise, com os
respectivos DGo’.
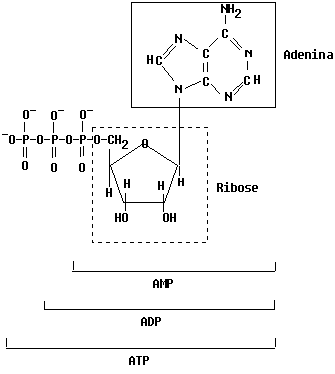 ATP
= Adenosina 5'-trifosfato
ATP
= Adenosina 5'-trifosfato
ALGUNS TIPOS DE ENZIMAS
Isomerases:
São enzimas que catalisam reações de isomerização.
Mutases:
São isomerases que catalisam a transferência de grupos fosfatos
de baixa energia de uma posição para a outra, dentro da mesma
molécula.
Desidrogenases:
São enzimas que catalisam reações de óxido-redução,
por transferência de hidrogênio do substrato para uma coenzima,
geralmente NAD+ ou FAD. Essas reações, na maioria
dos casos são reversíveis.
Aldolases:
São enzimas que cindem açúcares fosforilados, dando
origem a diidroxiacetona-fosfato e a outro açúcar, com 3
átomos de carbono a menos que o substrato original.
Fosfatases:
São enzimas que catalisam reações de hidrólise
de ésteres de fosfato.

INTRODUÇÃO
AO METABOLISMO
1.
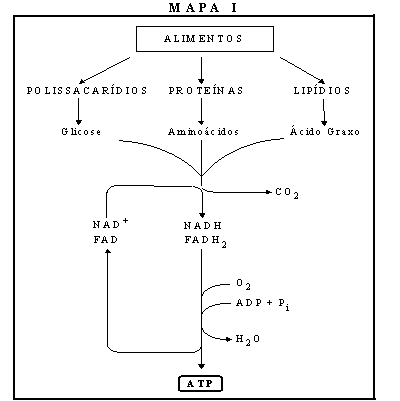
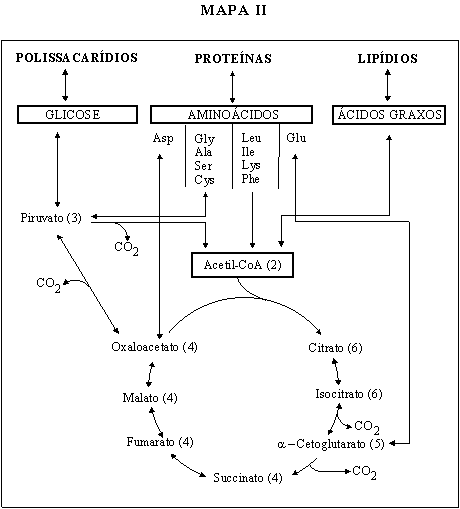
Considerar o mapa metabólico simplificado apresentado em Mapa II:
(a)
Quais são os passos irreversíveis que aparecem no mapa?
(b)
Qual é o primeiro composto comum que aparece na degradação
de proteínas, lipídeos e carboidratos?
(c)
Animais de laboratório foram submetidos a dietas compostas exclusivamente
de carboidratos, ou lipídeos, ou proteínas. Analisar em que
caso haveria sobrevivência, verificando se é possível
sintetizar:
ácido
graxo a partir de glicose
proteína
a partir de glicose
glicose
a partir de ácido graxo
proteína
a partir de ácido graxo
glicose
a partir de proteína
ácido
graxo a partir de proteína
Em
cada caso afirmativo, indicar a via utilizada
 |
 |
2.
Que compostos um indivíduo deve obrigatoriamente receber na dieta?
Utilizar apenas as informações do mapa metabólico
simplificado (Mapa II).
3.
Glicose é utilizada como fonte de energia para a célula,
ou organismo com a finalidade de produzir ATP. O excesso de glicose pode
ser convertido em gordura. O esquema simplificado abaixo mostra estas duas
possibilidades:
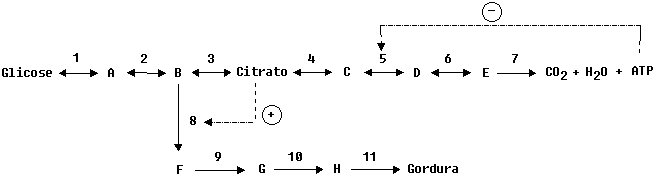
Discuta:
a)
Neste esquema, quais são as possíveis reações
catalisadas por enzimas alostéricas?
b)
Como funciona o esquema acima quando há disponibilidade de muita
glicose?
c)
O substrato B pode dar origem a dois produtos diferentes. Faça os
gráficos de velocidade em função da concentração
de B para cada uma das enzimas.
d)
Quando houver pouca disponibilidade de B qual seu caminho preferencial?
Por quê?
4.
Lehninger,
Principles of Biochemistry, Capítulo 13, Problema 5. Comparação
entre via catabólica e via anabólica. A interconversão
de glicose e frutose-1,6-difosfato, uma série muito importante de
etapas no metabolismo de carboidratos, é mostrada abaixo. A quebra
da glicose constitui a via catabólica, enquanto a biossíntese
de glicose a partir de frutose-1,6-difosfato corresponde a via anabólica.
Ambas as vias usam as mesmas hexoses monofosfato intermediárias.
Embora estas vias tenham semelhanças, elas apresentam diferenças
básicas. A finalidade deste exercício é reconhecê-las.
a)
Esquematize a reação balanceada para cada passo na via catabólica.
Escreva a equação líquida que resulta quando soma-se
os passos individuais.
b)
Repita o item (a) para a via anabólica.
c)
Baseado nas equações líquidas, quais são as
diferenças que podem ser notadas entre as vias catabólica
e anabólica? As duas vias são simplesmente o reverso uma
da outra?
d)
O que assegura o sentido das reações individuais no catabolismo
da glicose? Ou seja, o que impede que no catabolismo da glicose passe a
ocorrer por vias reversas?
e)
Nas vias catabólica e anabólica, a interconversão
de glicose e glicose-6-fosfato poderia ser catalisada pela mesma enzima?
Explique. A interconversão de glicose-6-fosfato e frutose-6-fosfato
nas vias catabólica e anabólica poderia ser catalisada pela
mesma enzima? Explique
GLICÓLISE
1.
Stryer,
Biochemistry, 3a ed., Capítulo 15, Problema 3. Escreva
a equação balanceada para a conversão da Glicose a
Lactato.
a)
Calcule a variação de energia livre padrão desta reação
usando os dados apresentados na tabela 15-2 do capítulo 15 do Stryer
(3a ed.) e levando em conta que o DGo'
para a reação Piruvato + NADH + H+®Lactato
+ NAD+, é igual a -6 kcal/mol
b)
Qual é a variação de energia livre (DG',
não DGo’)
para esta reação quando as concentrações de
reagentes e produtos são:
|
|
Glicose
|
5
mM
|
ADP
|
0,2
mM
|
|
|
Lactato
|
0,5
mM
|
Pi
|
1
mM
|
|
|
ATP
|
2
mM
|
|
|
3.
Discutir a regulação da via glicolítica em função
da relação ATP/ADP.
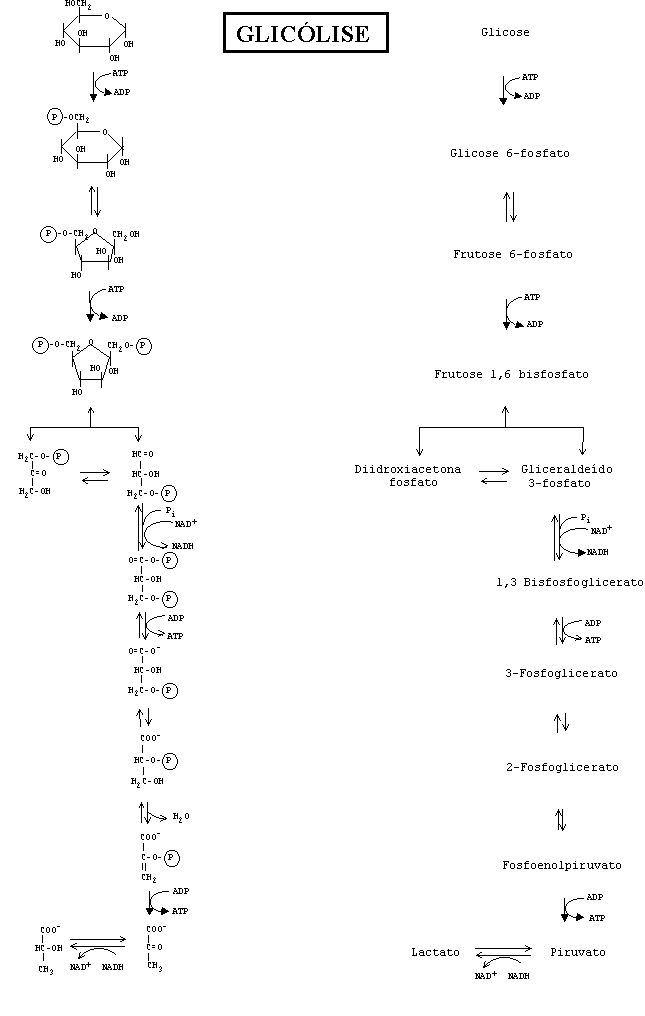 |
a)
Verificar os compostos que apresentam ligações do tipo: fosfoenol,
anidrido fosfórico e éster fosfórico e identificar
aqueles que são compostos ricos em energia
b)
Indicar as reações de oxidorredução
c)
Dizercomo é regulada a via
glicolítica e citar as enzimas e seus moduladores
d)
Mostrar os passos irreversíveis que fazem parte do mapa
e)
Determinar quantas moléculas de Ácido Pirúvico se
formam a partir de uma molécula de hexose
5.
Rawn,
Biochemistry, Capítulo, 12, Problema 14. Uma pessoa incapaz
de executar exercícios físicos intensos e prolongados teve
suas enzimas analisadas. Todas as enzimas da via glicolítica estavam
em concentração normal, com excessão da fosfoglicerato
mutase muscular.
a)
Como será afetada a produção de energia metabólica
em uma célula que apresenta baixos níveis desta enzima?
b)
Como será afetada a produção de Lactato na ausência
desta enzima? [Referência: Di Mauro, S.; Miranda, A.F.; Kahn, S.e
Gitlin, K. - Human muscle phosphoglycerate mutase deficiency Science
1981,212,
1277-1279.
b-OXIDAÇÃO
DE ÁCIDOS GRAXOS
1.
Carnitina é amplamente distribuída nos tecidos, mas atinge
concentração elevada no músculo. O que sugere este
dado?
2.
Cite os compostos que devem ser fornecidos para a manutenção
da espiral de Lynen.
3.
Compare a oxidação de 3 Glicose ®
Acetil-CoA, com a oxidação de Ácido Láurico
(12C) a Acetil-CoA, quanto a:
a)
Número de moléculas de Acetil-CoA formadas,
b)
Liberação de CO2,
c)
Gasto em ATP,
d)
Saldo de ATP e
e)
Número de moléculas de NADH ou FADH2 formadas
f)
Coenzimas e vitaminas envolvidas
g)
Localização celular
4.
Indique o caminho percorrido pelos carbonos do Glicerol na sua transformação
a Acetil CoA.
CICLO DE KREBS
1.
Quando uma preparação de mitocôndrias (convenientemente
tratada) é incubada com Acetil-CoA, verifica-se que para cada mol
de Acetil-CoA adicionado formam-se dois moles de CO2 e que a
velocidade de formação de CO2 (ml
de CO2/min) tem um valor A qualquer.
a)
Quando se adiciona Acetil-CoA + Succinato, observa-se que a velocidade
da produção de CO2 aumenta e o aumento de CO2
produzido excede a quantidade de Succinato adicionado, ou seja, o efeito
do Succinato é catalítico.
Discuta
as observações acima.
b)
O que aconteceria se a incubação fosse feita na presença
de Acetil-CoA + Succinato + Malonato?
2.
Como os intermediários do ciclo de Krebs poderiam ser repostos se
houvesse intensa síntese de Ácido Aspártico e Glutâmico
às custas dos intermediários do ciclo de Krebs?
3.
A carboxilase pirúvica é estimulada alostericamente por Acetil-CoA.
Discuta a importância deste fato para o metabolismo energético.
4.
Mostre como o ciclo de Krebs e a glicólise podem ser reguladas pela
isocitrato desidrogenase.
5.
Por que um esquimó com dieta deficiente em carboidratos estaria
nutricionalmente melhor comendo alimentos com lipídeos contendo
ácidos graxos com número ímpar de átomos de
carbono ao invés de número par?
6.
Use o Mapa II para responder às questões seguintes.
a.
Que composto é oxidado no ciclo de Krebs?
b.
Simultaneamente deve haver redução de alguma substância?Que
tipo de composto deve sofrer redução?
c.
Dispondo das enzimas necessárias, a adição de que
compostos fará aumentar a concentração de oxaloacetato
em um sistema “in vitro” que contém mitocôndrias: acetil-CoA,
piruvato, glutamato, citrato ou ácidos graxos?
d.
Uma suspensão de mitocôndrias, suplementada com acetil-CoA
marcada com C14, produz CO2 marcado apenas quando
suprida de oxigênio. Em condições anaeróbias,
a adição de azul de metileno restaura a produção
de CO2 marcado, observando-se também a descoloração
do corante (azul de metileno reduzido é incolor). Explique estes
dados.
CADEIA RESPIRATÓRIA
1.
A relação entre energia livre de uma reação
e o potencial redox é:
DGo’
= -nFDE0’onde
n é o número de elétrons transferidos
F
é a constante de Faraday (F = 23.60 cal V-1)
DEo'
é o, diferença de potencial padrão da dupla redox.
Utilizar
esta relação para calcular os pontos da cadeia respiratória
onde a energia "liberada" na reação de transferência
de elétrons poderia ser usada para a síntese de um composto
rico em energia, aproximadamente +7300 cal/mol.
2.
A uma solução 1 M de NAD+, NADH, Piruvato e Lactato,
adicionou-se lactato desidrogenase:
Lactato
+ NAD+«Piruvato
+ NADH + H+
Eo'
(NAD+/NADH) = -0,32 V
Eo'
(Piruvato/Lactato) = -0,19 V
a)
Em que sentido a reação ocorrerá?
b)
À medida que a reação ocorre, como variam esses potenciais
redox?
c)
Quando a reação atingirá o equilíbrio? Qual
o valor do, diferença de potencial redox (DE)
nessa situação?
3.
Citar as consequências dos seguintes fatores no funcionamento da
cadeia respiratória e da fosforilação oxidativa:
a)
Presença de KCN ou CO
b)
Carência de Pi
c)
Carência de ADP
d)
Presença de DNP (dinitrofenol)
e)
Carência de Pi e/ou ADP em presença de DNP
f)
Presença de oligomicina
g)
Presença de oligomicina + DNP
4.
Uma droga X inibe o consumo de O2 e a síntese de ATP
em uma suspensão de mitocôndrias. Que tipo de droga deveria
ser adicionada para se determinar o modo de ação da droga
X?
5.
Calcular o número de moléculas de ATP formadas na oxidação
total de:
I.glicose
(uma molécula)
II.
ácido palmítico (16C) (uma molécula)
a)
Qual seria o destino da energia não armazenada sob a forma de ATP?
b)
Qual seria o resultado na presença de dinitrofenol?
6.
Discutir o funcionamento do ciclo de Krebs, b-oxidação
e via glicolítica em uma suspensão de células hepáticas
na presença dos seguintes compostos: antimicina,
oligomicina, dinitrofenol, antimicina + dinitrofenol e oligomicina + dinitrofenol. Justificar.
7.
A membrana externa da mitocôndria é permeável à
maioria dos solutos de baixo peso molecular. A membrana interna, entretanto,
possui seletividade, sendo impermeável por exemplo a coenzimas,
nucleotídeos, etc. De posse dessas informações responder
as seguintes indagações:
a)
Como os acil-CoA produzidos após ativação dos ácidos
graxos podem ser degradados na b-oxidação?
b)
Como o NADH produzido na via glicolítica pode ser reoxidado na cadeia
respiratória?
c)
Como o ATP produzido na cadeia respiratória pode ser utilizado nas
biossínteses que ocorrem no citoplasma?
8.
Um microorganismo aeróbico facultativo é cultivado em meio
líquido glicosado com aeração e sem aeração.
Em qual das duas culturas o consumo de glicose pelas células é
maior? Justificar a resposta em termos de regulação metabólica.
9.
Aceita-sequea
oxidação deNADH ao
nívelde cadeiarespiratóriaproduz,
em média, 3 ATP. É conhecido que existem "sítios"
de produção de ATP (quais?). Discutir a relação
estequiométrica e a existência de "sítios" à
luz da teoria do acoplamento quimiosmótico.
VIA DAS PENTOSES
1.
Para efeito de melhor compreensão, pode-se considerar que a via
das pentoses constitui-se de um ramo oxidativo (transformação
irreversível de glicose-6-fosfato a pentoses) e de um ramo não
oxidativo (transformação reversível de pentoses a
frutose-6-fosfato e gliceraldeído-3-fosfato). Partindo-se de glicose-6-fosfato
e considerando-se estes dois ramos, pede-se indicar como podem ser obtidos
os seguintes intermediários quando uma determinada célula
deles necessite em grandes quantidades:
a)
ribose-5-fosfato
b)
ribose-5-fosfato e NADPH
c)
NADPH
2.
Experimentos com glicose-6-fosfato marcada com isótopo radioativo
(14C) no C1 ou no C6 indicam quanto do
substrato inicial é metabolizado pela via das pentoses e quanto
é metabolizado pela ação combinada da glicólise
e ciclo de Krebs. Uma alíquota do homogenato do tecido em estudo
é incubada com glicose-6-fosfato com
14C no C1
e outra, com o mesmo substrato com 14C no C6. Que
resultado deve ser esperado, em termos de produção de 14CO2
em função do tempo, se o homogenato metaboliza glicose-6-fosfato:
a)
Somente pela ação combinada da glicólise e ciclo de
Krebs,
b)
Somente pela via das pentoses, e
c)
Pelas duas vias simultaneamente
3.
Discutir as condições em que deverá haver predomínio
de uma das vias (glicólise ou via das pentoses) no metabolismo da
glicose. Citar os tecidos onde a via das pentoses é mais ativa.
4.
Esquematizar o catabolismo da glicose na hemácia enfatizando:
a)
O destino do lactato
b)
A função do NADPH
A
hemácia é uma célula que metaboliza aeroticamente
glicose? Ela utiliza o oxigênio transportado pela
hemoglobina?
5.
Ler o Stryer, no cap. referente a Via das Pentoses, o tópico:
"A deficiência de glicose-6-fosfato desidrogenase causa anemia hemolítica
induzida por droga".
BIOSSÍNTESE DE ÁCIDOS
GRAXOS
1.
Escrever a equação de síntese de ácido palmítico
(16C) a partir de Acetil-CoA.
2.
Comparar a b-oxidação
com a biossíntese de ácidos graxos no complexo multienzimático
quanto a:
a)
Localização celular
b)
Coenzimas envolvidas e suas vitaminas
c)
Carregador de grupo acila
d)
Forma em que as unidades de carbono são removidas ou adicionadas
3.
Comparar a degradação de ácido palmítico até
acetil-CoA com sua síntese a partir de acetil-CoA quanto a necessidade
de:
a)
ATP
b)
Coenzimas
4.
Discutir a regulação da síntese de ácidos graxos
em função da relação ATP/ADP.
5.
A síntese de triglicerídeos requer glicerol-3-fosfato, mas
o tecido adiposo não possui a enzima glicerol quinase. Como os adipócitos
obtém esse composto essencial para a estocagem de ácidos
graxos ?
6.
Verificar em quais das seguintes situações haverá
estímulo da formação de corpos cetônicos:
a)
Dieta rica em carboidratos e normal em lipídeos,
b)
Jejum,
c)
Dieta rica em lipídeos e normal em carboidratos e
d)
Diabetes.
7.
Em caso de jejum prolongado o cérebro passa a oxidar também
corpos cetônicos, além de glicose, como fonte de energia.
Citar as enzimas que o cérebro deve sintetizar nessa adaptação
metabólica.
8.
Citar as vias de produção e de utilização de
acetil-CoA pela célula.
9.
Explicar com base na regulação de enzimas alostéricas
o fato de uma dieta rica em carboidratos promover o acúmulo de lipídeos.
GLICONEOGÊNESE
1.
O hepatócito pode reverter a transformação de glicose
em piruvato apesar de haver três reações irreversíveis
na glicólise. Em cada uma dessas etapas, comparar as reações
no sentido glicose®piruvato
e piruvato ®
glicose, quanto às enzimas, reagentes, produtos e coenzimas.
2.
Lactato produzido pelo músculo e pelas hemácias pode ser
utilizado pelo fígado para convertê-lo novamente em glicose.
Calcular o número de moléculas de ATP, por molécula
de glicose, necessário a essa conversão.
3.
Lehninger,
Princípios de Bioquímica. Capítulo, 20, Problema 4.
Quais são os efeitos de concentração crescente de
ATP e AMP nas atividades catalíticas de frutose difosfatase e fosfofrutoquinase?
Quais são as consequências destes efeitos do ATP e AMP no
fluxo relativo dos metabolitos através da neoglicogênese e
da glicólise?
4.
Lehninger,
Princípios de Bioquímica, Capítulo 20, Problema 5.
Um procedimento comum para determinação da efetividade de
compostos como precursores da glicose é colocar um animal em jejum
até que os estoques de glicogênio do fígado sejam depletados
e então administrar o substrato em questão. Um substrato
que leva a um aumento líquido no glicogênio hepático
é chamado de glicogênico pois ele deve primeiro ser convertido
em glicose-6-fosfato. Mostre por meio de reações enzimáticas
conhecidas quais das seguintes substâncias são glicogênicas:
a)succinato,
b)
glicerol,
c)
acetil CoA,
d)
piruvatoe
e)
butirato.
Escreva
as fórmulas estruturais das substâncias relacionadas de (a)
a (e).
5.
Lehninger,
Princípios de Bioquímica, Capítulo 20, Problema 6.
As concentrações de lactato no plasma sanguíneo, antes,
durante e depois de uma corrida de 400 metros serão mostradas no
gráfico (ver no livro) concentração de lactatosanguíneo
versus
tempo, a ser fornecido durante a aula.
a)
O que provoca a rápida elevação na concentração
do lactato?
b)
Oqueprovocao
declínio do nível dolactatodepoisdo
término dacorrida? Por que
o declínio ocorre mais lentamente de que a elevação?
c)
Por que a concentração do lactato não é zero
durante o estado de repouso?
SÍNTESE E DEGRADAÇÃO
DO GLICOGÊNIO
1.
Esquematizar simplificadamente a estrutura da molécula do glicogênio
indicando os terminais não redutores, redutor e pontos de ramificação
e mostrar as ações das seguintes enzimas envolvidas na degradação
do polissacarídeo a glicose-6-fosfato:
a)
fosforilase,
b)
transferase (enzima de desramificação),
c) a-1,6-glicosidase,
d)
fosfoglicomutase
2.
Lehninger, Princípios de Bioquímica, Capítulo 20,
Problema 9. Escrever a sequência e a reação global
requeridas para calcular o custo em número de moléculas de
ATP necessárias para a conversão de glicose-6-fosfato citoplasmática
em glicogênio e deste de volta a glicose-6-fosfato. Que fração
do número máximo de moléculas de ATP, que é
disponível no catabolismo completo da glicose-6-fosfato, este custo
representa?
3.
Lehninger,
Princípios de Bioquímica, Capítulo 20, Problema 10.
Uma amostra de tecido de fígado foi obtida "post-mortem" do corpo
de um paciente, o qual acreditava-se ser geneticamente deficiente em uma
das enzimas do metabolismo de carboidratos. Um homogenato da amostra do
fígado mostrou as seguintes características:
1.
Degradou glicogênio a glicose-6-fosfato
2.
Foi incapaz de sintetizar glicogênio a partir de qualquer açúcar
mais simples, ou utilizar galactose como fonte de energia, e
3.
Sintetizou glicose-6-fosfato a partir de lactato.
Qual
das três enzimas seguintes é deficiente?
a)
glicogênio fosforilase,
b)
frutose difosfatase,
c)
UDP-glicose pirofosforilase
Fornecer razões para sua escolha
4.
Nível alto de insulina no sangue indica que o organismo está
bem nutrido (período logo após a refeição).
Nível baixo, por outro lado denota estado de jejum. Glucagon age
de maneira oposta à de insulina. Adrenalina tem ação
semelhante à do glucagon.
Relacionar
estas afirmações com o papel destes hormônios na síntese
e degradação do glicogênio.
5.
Existem várias doenças relacionadas com alterações
no metabolimo do glicogênio. Nestas doenças certas enzimas
são produzidas em forma defeituosa, ou em quantidade deficientes
ou mesmo não são produzidas.
Indicar,
nos casos assinalados, na sequência das reações metabólicas,
o passo que é afetado e o que isto implica na síntese e/ou
degradação do glicogênio.
|
|
|
|
|
|
Von
Gierke
|
glicose-6-fosfatase
|
|
|
Cori
|
a-1,6-glicosidase
|
|
|
McArdle
|
fosforilase
de músculo
|
|
|
Andersen
|
enzima
ramificadora
|
METABOLISMO DE AMINOÁCIDOS
1.
Esquematizar as reações que permitem a síntese da
maioria dos aminoácidos a partir de NH3, a-cetoglutarato
e a-cetoácidos
correspondentes. Discutir as implicações da reversibilidade
das reações.
2.
Lehninger,
Princípios de Bioquímica, Capítulo 19, Problema 6.
Os três átomos de carbono no lactato e alanina tem estados
de oxidação idênticos, e animais podem usar qualquer
um destes compostos como combustível metabólico. Comparar
o rendimento líquido de ATP (moles de ATP por mol de substrato)
para a oxidação completa (a CO2 e H2O)
de lactato versus alanina quando o custo de excreção
de nitrogênio como uréia é incluído.
3.
A alanina desempenha um papel importante no transporte de amônia
para o fígado, numa forma não tóxica. A amônia
produzida no músculo e outros tecidos, principalmente pela degradação
de aminoácidos, torna-se o a-amino
grupo da alanina e destaforma é
transportada do músculo (e outros tecidos) para o fígado
através da corrente sanguínea. No fígado, a alanina
perde o amino grupo que é eliminado como uréia. O esqueleto
carbônico da alanina é convertido em glicose, que volta através
da corrente sanguínea ao músculo. Esta interrelação
entre músculo e fígado é chamada ciclo da alanina-glicose.
Esquematize
o ciclo da alanina-glicose. Identifique as vias metabólicas envolvidas
em células de músculo e fígado.
4.
Lehninger,
Princípios de Bioquímica, Capítulo 9, Problema 4.
Uma criança de dois anos de idade foi levada ao hospital. Sua mãe
indicou que ela vomitava frequentemente, especialmente após as refeições.
O peso da criança e o seu desenvolvimento físico estavam
abaixo do normal. Seus cabelos, embora escuros, continham porções
de cabelos brancos. Uma amostra de urina tratada com cloreto férrico
(FeCl3) apresentou cor verde característica da presença
de ácido fenilpirúvico. A análise quantitativa de
amostras de urina apresentou os resultados mostrados na tabela abaixo:
|
|
Substância
|
(mmol/l) |
(mmol/l) |
|
|
Fenilalanina
|
|
|
|
|
Fenilpiruvato
|
|
|
|
|
Fenilactato
|
|
|
a)
Sugerir a enzima que possa estar deficiente. Propor um tratamento para
esta condição.
b)
Por que a fenilalanina aparece na urina em grandes quantidades?
c)
Qual é a fonte de fenilpiruvato e do fenilactato? Por que estas
vias (normalmente não funcionais) entram em ação quando
a concentração de fenilalanina se eleva?
d)
Por que o cabelo da paciente apresenta porções brancas?
5.
Analisar as consequências, para o metabolismo geral, de uma dieta
calórica normal e contendo proteínas de baixo valor biológico
(proteína com baixo conteúdo em aminoácidos essenciais).
Definir
balanço de nitrogênio. O que significa balanço de nitrogênio
negativo, zero e positivo?
AÇÃO HORMONAL
1.
Lehninger,
Princípios de Bioquímica, Capítulo 25, Problema 3.
Baseados nas suas propriedades físicas, os hormônios caem
em duas categorias; aqueles que são muito solúveis em água
mas relativamente insolúveis nos lipídeos, por exemplo, a
adrenalina, e aqueles que são relativamente insolúveis em
água mas altamente solúveis nos lipídeos, por exemplo,
os hormônios esteroídicos. Na sua função de
reguladores da atividade celular, a maioria dos hormônios hidrossolúveis
não penetra nas células dos tecidos-alvo. Os hormônios
lipossolúveis, por outro lado, penetram nas células-alvo
e finalmente atuam no núcleo. Qual é a base para a correlação
entre solubilidade, a localização dos receptores e o modo
de ação destas duas categorias de hormônios?
2.
Lehninger,
Princípios de Bioquímica, Capítulo 25, Problema 4.
Na década de 50, Earl Sutherland e seus colegas realizaram experimentos
pioneiros para elucidar o mecanismo de ação da adrenalina
e do glucagon. À luz da nossa atual compreensão da ação
hormonal interprete cada um dos seus experimentos descritos abaixo. Identifique
os componentes e indique o significado dos resultados.
a)
A adição da adrenalina a um homogeneizado ou preparação
de células rompidas do fígado normal resulta num aumento
da atividade da glicogênio fosforilase. Entretanto, se o homogeneizado
for primeiro centrifugado numa alta velocidade e a adrenalina ou o glucagon
adicionados à fração sobrenadante límpida,
nenhum aumento na atividade da sua fosforilase é observado.
b)
Quando a fração particulada, sedimentada de um homogeneizado
do fígado por centrifugação é preparada e tratada
com adrenalina, uma nova substância é produzida. Esta substância
foi isolada e purificada. Ao contrário da adrenalina, esta substância
ativa a glicogênio fosforilase quando adicionada à fração
sobrenadante do homogeneizado.
c)
A substância formada pela fração particulada era estável
ao calor; isto é o tratamento com calor não impedia sua capacidade
de ativar a glicogênio fosforilase (Dica: seria este o caso se a
substância fosse uma proteína?). A substância era idêntica
a um composto obtido quando ATP puro era tratado com hidróxido de
bário.
3.
Lehninger,
Princípios de Bioquímica, Capítulo 25, Problema 7.
Durante uma situação de "lutar ou correr", a liberação
de adrenalina promove a degradação do glicogênio no
fígado, coração e músculo esquelético.
O produto da degradação do glicogênio no fígado
é a glicose. Ao contrário, o glicogênio do músculo
esquelético é degradado pela glicólise:
a)
Por que produtos diferentes são observados na degradação
do glicogênio nestes dois tecidos diferentes?
b)
Qual é a vantagem para o organismo durante uma condição
de "lutar ou correr", de se ter estas vias específicas de degradação
do glicogênio?
4.
Lehninger,
Princípios de Bioquímica, Capítulo 25, Problema 8.
Certos tumores malignos do pâncreas provocam uma excessiva produção
de insulina pelas células B. Tais pacientes apresentam calafrios
e tremores, fraqueza e fadiga, sudorese e fome. Se esta condição
se prolongar ocorre lesão cerebral. Qual é o efeito do hiperinsulinismo
no metabolismo dos carboidratos, aminoácidos e lipídeos do
fígado? Quais são as causas dos sintomas observados? Sugira
por que esta condição, se prolongada, leva a lesão
cerebral?
INTEGRAÇÃO
METABÓLICA
1.
Os nutrientes absorvidos no trato intestinal passam diretamente ao fígado
(com exceção de uma grande parte de triacilgliceróis).
Por este grande centro de distribuição, açúcares,
aminoácidos e alguns lipídeos são processados e distribuídos
aos outros órgãos e tecidos. Propor um mapa metabólico
unificado, integrando as principais vias destes nutrientes neste órgão.
2.
Ao contrário do músculo esquelético, o músculo
cardíaco deve trabalhar constante e ritmicamente. O que torna possível,
a nível de metabolismo e características da célula
cardíaca, esta adaptação para o trabalho constante?
3.
Lehninger,
Princípios de Bioquímica, Capítulo 24, Problema 14.
O glicerol-3-fosfato é um intermediário chave na biossíntese
dos triacilgliceróis. As células adiposas, que são
especializadas na síntese e degradação dos triacilgliceróis,
não podem usar o glicerol diretamente devido à falta da gliceroquinase,
que catalisa a reação:
Glicerol + ATP ®
Glicerol-3-fosfato + ADP
Como
o tecido adiposo obtém o glicerol-3-fosfato necessário para
a síntese do triacilglicerol? Explicar.
4.
Lehninger,
Princípios de Bioquímica, Capítulo 24, Problema 20.
Pacientes com deficiência de tiamina exibem um conjunto de sinais
neurológicos característicos: perda dos reflexos, estado
de ansiedade e confusão mental. Sugira uma razão por que
a deficiéncia de tiamina é manifestada na função
cerebral.
5.
A tabela (a ser fornecida na sala de aula) indica vários efeitos
da deficiência de insulina (Diabetes mellitus) no metabolismo.
Para cada um dos ítens compare com uma situação em
que o organismo foi submetido a jejum severo.
(Ver
tabela 25-6 do Lehninger, Princípios de Bioquímica, Capítulo
25).
6.
Van
Eikeren, Guide to Lehninger’s Principles of Biochemistry, Capítulo
26 (Nutrição Humana), Challenge Problems, Problema 19.Acidose
láctica e hipoglicemia em dependentes de álcool.
Pessoas
que consomem muita bebida alcoólica desenvolvem níveis sangüíneos
não normais e baixos de glicose (hipoglicemia), maiores do que os
normais de ácido láctico (acidose láctica suave) e
ainda apresentam cetose. Explique.