-Organizações
de estruturas biológicas
-Evolução
de vida célular
-Composição
elementar de seres vivos:
Superfície
da Terra é composto de 47% O, 28% Si, 7,9% Al, 4,5% Fe, 3,5% Ca,
Carbono –
faz ligações C-C muito estáveis
-
faz cadeias ramificadas que aumenta a complexidade dos compostos
-cadeias
de N, Si ou P são instáveis por causa de repulsões
entre elétrons não-pareados (N e P)
e
- ligações
C-N, C-O e C-S são menos estáveis
-Enorme
variação de tipos de moléculas poliméricas:
a)
Protéinas – polímeros de aminoácidos; funções
estruturais e catalíticos e transportadoras
b)
Carboidratos – polímeros de açucares; funções
estruturais e de reconhecimento
c)
Lipídeos – esteres de glícerol e ácidos graxos; funções
estruturais nas membranas biológicas
d)
Combinações dos três típos acima citados, por
exemplo glicoproteínas, glicolipídeos e lipoproteínas
e)
Ácidos nucleicos – polimeros de nucleotídeos que são
feitos de um grupo fosfato, um açucar (ribose ou 2’-dessoxiribose)
e uma base nitrogenada (C,G,A,T ou U).
f)
outras moléculas pequenas – vitaminas, venenos, cofatores, antibióticos,
hormônios,
-Água
-
maioria dos organismos são 70% água
-suas
propriedades e suas interações com as outras biomoléculas
sempre tem que ser consideradas para entender as suas funções
-proteínas
são polímeros de aminoácidos
-aminoácidos
tem a fórmula geral:NH2-CH(R)-CO2H
-
-o
grupo a-amino
é básico, ex: tire um H+ da água:
-
o grupo carboxila é ácido, ex: perde um H+ para
água:
-
Logo, aminoácidos estão encontrados normalmente na forma
“zwiteriônica”:
-
cadeias alifáticas: somente carbono e hidrogênio (A, V, L,
I, P)
-
cadeias aromáticas: –CH2-benzeno, CH2-fenol,
-CH2-indol (F, Y, W)
-
cadeias polares não carregadas: grupos –OH, -SH, -C(=O)NH2
(S, T, C, N, Q)
-
cadeias polares ionizáveis (pH 7): grupos –CO2-,
NH3+, -CH-NH(=NH2+)-NH2,
-CH2-imidazol (D,E, K, R, H)
-
cadeias ionizaveis em condições especiais: grupos -SH, CH2-fenol
(C, F)
-
cadeia com somente –H (G)
-
iminoácido (prolina, P)
-
cadeias contendo enxofre (C, M)
ácidos
e bases
-grupos
ionizáveis dos aminoácidos (a-amino,
carboxila, ou R) se comportam como ácidos fracos (AH) em que o a
forma ácida (AH) e a forma básica (A-) existem em equilibrio:
As
concentrações relativas da forma AH, A- reação
é H+ são representadas pela constante de equilíbrio
(Ka)
Ka
= [A-][H+]/[AH]
{notar:
para grupos básicos (ex. -NH2):
a
forma ácida tem carga (ex.: AH+ =-NH3+)
e
a forma básica é neutra (ex.: A = -NH2);
Logo,
nestes casos: Ka = [A][H+]/[AH+]}
O
valor da Ka descreve a tendência para o ácido perder o seu
grupo H+
O
valor do Ka é um “constante”, especifico para aquele grupo e o “ambiente
químico” onde o grupo se encontra.
As
concentrações relativas da forma AH, A- são
determinados pelo valor de Ka e pela concentração de [H+]
no meio:
Em
água pura, a concentração de H+ é
1 x 10-7 mol/L
Em
condições ácidas [H+] > 10-7
Em
condições básicas [H+] < 10-7
Definimos:
pH = -log[H+]ou[H]
= 10-pH
Definimos:
pKa=-logKaouKa
= 10-pKa
Ka
= [A-][H+]/[AH]
logKa
= log([A-][H+]/[AH])
logKa
= log[H+] + log([A-]/[AH])
-pKa
= -pH + log([A-]/[AH])
pH
= pKa + log([A-]/[AH])Equação
Henderson-Hasselbach: relaciona as quantidades relativas
da
forma básica e ácida [A-]/[AH] com o pH do meio.
É
simplesmente uma forma “logaritmica” para expressar a equação
de equilíbrio.
CH3CO2H <=> CH3CO2- + H+
(AH)(A-)
quer
determinar o valor de x
(pH
= -logx)
2
jeitos de solucionar:
i/
assumir que [HA] = 1 mol/L(quer
dizer que x <<< 1M)
ii/
não assumir que [HA] = 1 mol/L(solução mais rigorosa)
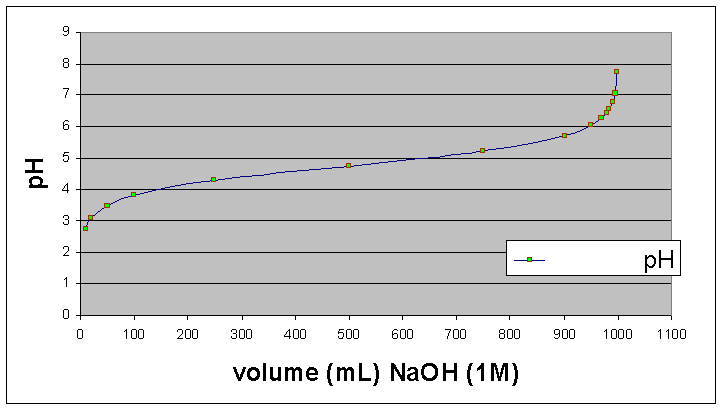
Problema:
Para uma solução de 1 L de 1M ácido acético
cujo pKa é 4,76, desenhar a curva de pH versus volume de 1 M NaOH
adicionado.
Solução:
antes
de adicionar NaOH, 1L de 1 M ácido acético tem 1 mol de ácido
na forma (HA)
O
NaOH é um base forte e reage estoiquiometricamente com ácido
acético:
CH3CO2H(aq)
+ NaOH(aq) <=> CH3CO2-(aq)
+ Na+(aq) + H2O
(AH)(A-)
logo,
depois de adicionar “x” mL de NaOH, a razão [CH3CO2-]/[CH3CO2H]
= [A-]/{HA] = x/(1000-x)
logo
depois de adicionar “x”mL de NaOH:
pH
= pKa + log([A-]/[AH]) (Henderson-Hasselbach
eqn.)
pH = 4,76
+ log(x/(1000-x))
|
mL
1M NaOH
|
[A-]/[HA]
|
log[A-]/[HA]
|
pH
|
|
10
|
0,010
|
-2,00
|
2,76
|
|
20
|
0,020
|
-1,69
|
3,07
|
|
50
|
0,053
|
-1,28
|
3,48
|
|
100
|
0,111
|
-0,95
|
3,81
|
|
250
|
0,333
|
-0,48
|
4,28
|
|
500
|
1,000
|
0,00
|
4,76
|
|
750
|
3,000
|
0,48
|
5,24
|
|
900
|
9,000
|
0,95
|
5,71
|
|
950
|
19,000
|
1,28
|
6,04
|
|
970
|
32,333
|
1,51
|
6,27
|
|
980
|
49,000
|
1,69
|
6,45
|
|
985
|
65,667
|
1,82
|
6,58
|
|
990
|
99,000
|
2,00
|
6,76
|
|
995
|
199,000
|
2,30
|
7,06
|
|
999
|
999,000
|
3,00
|
7,76
|
Titulação de 1 L de 1 M ácido acético com 1M NaOH
PONTOS
IMPORTANTES PARA LEMBRAR:
-quando
metade do ácido foi neutralizado, [HA] = [A-], e pH =
pKa
-quando
metade do ácido foi neutralizado, a inclinação da
curva é baixo e o pH é relativamente insensivel à
adição de mais base. Neste situação, a soluçõa
tem propriedades tamponantes, quer dizer, ela consege manter o pH mais
ou menos constante apesar de adição de base ou ácido.
Notar que entre pH 4,2 e 5,2 a solução absorveu 500 mL de
um base forte e o pH mudou somente 1 unidade de pH.
-Em
termos gerais, um tampão é efeitivo somente na faixa de pH
= (pKa +/- 1), neste caso entre pH 3,76 e 4,76. Fora desta faixa, o pH
é mais sensível a adição de base ou ácido
(a inclinaçõa da curva é maior).
-Outro
fator importante para a habilidade tamponante de uma solução
é a concentração do tampão; geralmente expressa
na forma [HA]+[A-] ou (moles HA + moles A-); logo no caso acima,
a concentração do tampão é 1 M (no começo
da titulação)
-Na
ausência de um tampão, a adição de 1 mL de NaOH
à água causaria o pH aumentar de pH 7 para pH 11 e a adição
de 1 mL de HCl (um ácido forte) a água causaria o pH diminuir
de pH 7 para pH 3 .
-Quando
o pH > pKa, a molécula se encontra predominamente na forma básica
ou desprotonada (A-);
quer
dizer: [A-]>>[AH] e [A-]/[AH]>>1
-Quando
o pH < pKa, a molécula se encontra predominamente na forma ácida
ou protonada (AH);
quer
dizer: [A-]<<[AH] e[A-]/[AH]<<1
Um
aminoácido na sua forma livre tem propriedades de um ácido
poliprótico: um ácido que tem mais de um H+ que
pode ser liberado para água ou neutralizado por um base.
O
grupo carboxila tem pKa ~ 2 e o grupo amino tem pKa ~ 9
Logo,
para um aminoácido cujo cadeia lateral não é ionizável:
quando
o pH = 1, a forma predominante é: NH3+-CH(R)-CO2H
pois
o pH (1) é bem menor dos pKas de ambos os grupos
quando
o pH = 2, as formas predominantes são NH3+-CH(R)-CO2H
(50%)ßà
NH3+-CH(R)-CO2-
(50%)
pois
o pH (2) é igual a pKa do grupo carboxila e menor do que o pKa do
grupo a-amino
quando
o pH = 7, a forma predominante é: NH3+-CH(R)-CO2-
pois
o pH (7) é bem maior do pKa do grupo carboxila e bem menor do pKa
do grupo a-amino
quando
o pH = 9, as formas predominantes são NH3+-CH(R)-CO2-
(50%)ßà
NH2-CH(R)-CO2-
(50%)
pois
o pH (9) é bem maior do pKa do grupo carboxila e igual ao pKa do
grupo a-amino
quando
o pH =11 a forma predominante é: NH2-CH(R)-CO2-
pois
o pH (11) é bem maior do pKa do grupo carboxila e do pKa do grupo a-amino
Os
pontos de uma curva de titulação de um aminoácido
com estas caracteristicas podem ser calculados quantitativamente usando
a equação Henderson-Hasselbach (vide a tabela seguinte) ou
traçado qualitativamente utilizando os pontos principais descritos
acima.
|
mL
1M NaOH
|
[A-]/[HA]
|
log[A-]/[HA]
|
pH
|
||
|
10
|
0,0101
|
-1,9956
|
0,0044
|
*
|
|
|
20
|
0,0204
|
-1,6902
|
0,3098
|
*
|
*Titulação
|
|
50
|
0,0526
|
-1,2788
|
0,7212
|
*
|
|
|
100
|
0,1111
|
-0,9542
|
1,0458
|
*
|
Do
|
|
250
|
0,3333
|
-0,4771
|
1,5229
|
*
|
|
|
500
|
1,0000
|
0,0000
|
2,0000
|
*
|
Grupo
|
|
750
|
3,0000
|
0,4771
|
2,4771
|
*
|
|
|
900
|
9,0000
|
0,9542
|
2,9542
|
*
|
Carboxila
|
|
950
|
19,0000
|
1,2788
|
3,2788
|
*
|
|
|
970
|
32,3333
|
1,5097
|
3,5097
|
*
|
|
|
980
|
49,0000
|
1,6902
|
3,6902
|
*
|
|
|
985
|
65,6667
|
1,8173
|
3,8173
|
*
|
|
|
990
|
99,0000
|
1,9956
|
3,9956
|
*
|
|
|
995
|
199,0000
|
2,2989
|
4,2989
|
*
|
|
|
1010
|
0,0101
|
-1,9956
|
7,0044
|
#
|
|
|
1020
|
0,0204
|
-1,6902
|
7,3098
|
#
|
|
|
1050
|
0,0526
|
-1,2788
|
7,7212
|
#
|
#Titulação
|
|
1100
|
0,1111
|
-0,9542
|
8,0458
|
#
|
|
|
1250
|
0,3333
|
-0,4771
|
8,5229
|
#
|
Do
|
|
1500
|
1,0000
|
0,0000
|
9,0000
|
#
|
|
|
1750
|
3,0000
|
0,4771
|
9,4771
|
#
|
Grupo
|
|
1900
|
9,0000
|
0,9542
|
9,9542
|
#
|
|
|
1950
|
19,0000
|
1,2788
|
10,2788
|
#
|
alfa-amino
|
|
1970
|
32,3333
|
1,5097
|
10,5097
|
#
|
|
|
1980
|
49,0000
|
1,6902
|
10,6902
|
#
|
|
|
1990
|
99,0000
|
1,9956
|
10,9956
|
#
|
|
|
1995
|
199,0000
|
2,2989
|
11,2989
|
#
|
Titulação
de 1L de 1M glicina.HCl (pKa 2 e 9) com 1 M NaOH
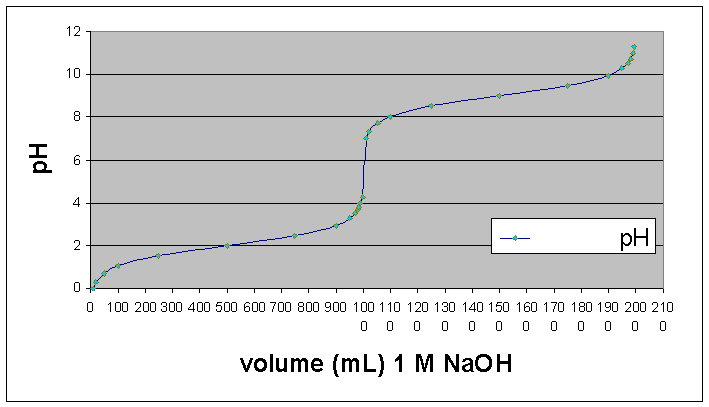
Pode
perceber que glicina tem poder tamponante em volta de pH 2 e pH 9, quando
o pH é próximo a pKa dos seus grupos ionizáveis.