
Laboratório
de Bioquímica de Oxidantes e Radicais e EPR
 Exemplos
de radicais detectados pelo grupo.
|
|
INTERESSES DE PESQUISA
|
Nosso
grupo de pesquisa sempre objetivou compreender os mecanismos moleculares
pelos quais radicais livres e oxidantes medeiam respostas biológicas
que vão desde a sinalização de circuitos envolvidos em fisiologia e
fisiopatologia até lesões a células e tecidos.
Pelo uso da ressonância paramagnética eletrônica (EPR) e de estudos
cinéticos, dentre outras abordagens experimentais, contribuímos para
caracterizar novas espécies reativas, tais como radicais alquila/arila
(R●/Ar●), peroxinitrito (ONOO-),
peroxymonocarbonate (HCO4-) e radical carbonato
(CO3●-). Também contribuímos para estabelecer
suas fontes e destinos biológicos. Estudando a reatividade de radicais
e oxidantes com potenciais alvos biológicos in vitro e in vivo, pretendemos
continuar contribuindo para avançar o campo da biologia redox. Concordamos
com a visão de que novos avanços dependerão de abordagens interdisciplinares
que combinem biologia de sistemas com rigorosos estudos químicos e biológicos. |
|
Vagas para
pós-doutores e estudantes de pós-graduação
PESQUISAS
EM DESENVOLVIMENTO
Atualmente estamos abordando os problemas abaixo colocados.
i) As propriedades redox do principal tampão fisiológico, o par bicarbonato/dióxido de carbono. Além de contribuir para a compreensão e o controle de várias condições clínicas (como enfisema, fibrose pulmonar, paralisia respiratória), tais propriedades podem impactar nossa visão sobre como o aumento dos níveis atmosféricos de dióxido de carbono afetará a vida no planeta.
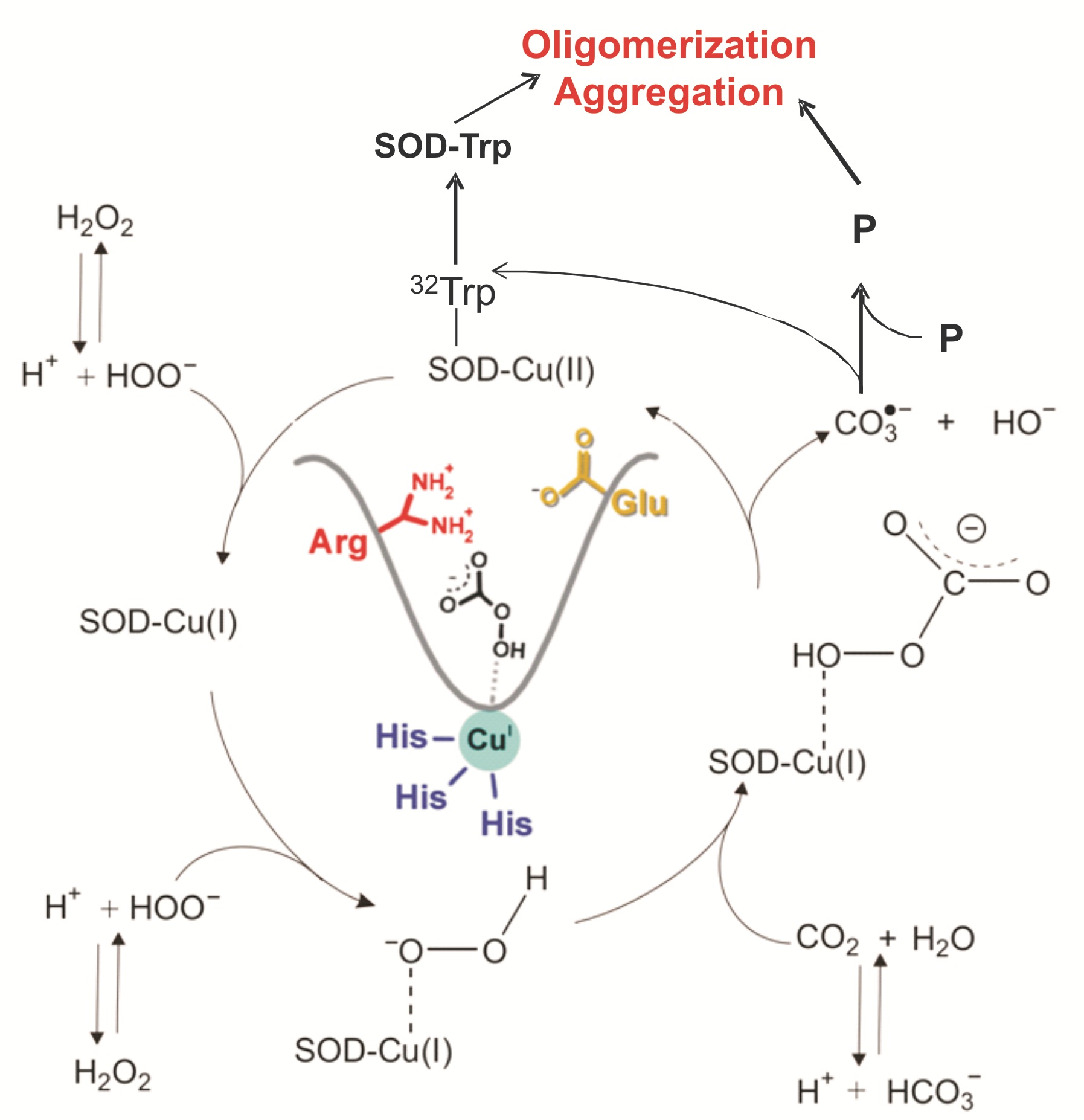
Produção
do radical carbonato durante a atividade peroxidásica da SOD1 resultando na
oxidação de proteínas a radicais e
suas eventuais oligomerizações e agregações. Nossos trabalhos anteriores:
Medinas
et al, IUBM Life, 2007; Chem Res Toxicol, 2009 and
Free Radic Biol Med, 2010.
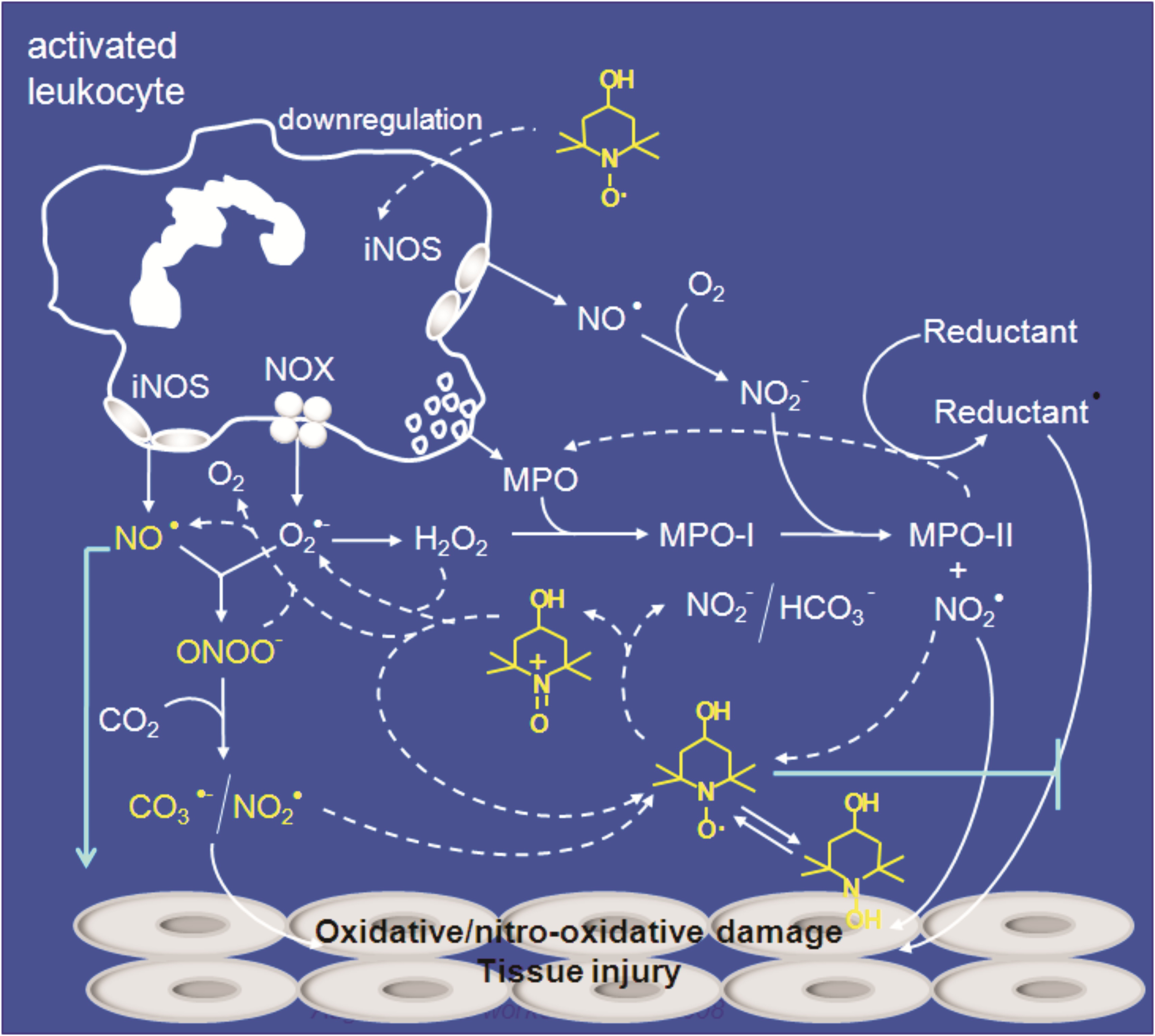 |
iii)
Os mecanismos pelos quais nitróxidos cíclicos protegem células e animais experimentais
de dano oxidativo e nitro-oxidativo. Tais estudos são relevantes porque nitróxidos
cíclicos poderão levar ao desenvolvimento de novas estratégias antioxidantes
a anti-inflamatórias.
Mecanismos pelos quais o
nitróxido cíclico tempol pode atenuar a injúria inflamatória. Nossos trabalhos
anteriores: Augusto et al, An Acad. Bras. Cienc, 2008; Vaz and Augusto, Proc. Natl
Acad Sci USA, 2009; Linares et al, Free Radic Biol Med, 2009; Queiroz et al,
Biochem J, 2011. |
|

Copyright Oficina de Textos |
PUBLICAÇÕES
Publicações totais até Maio de 2012: -116
artigos em revistas com avaliação por pares. peer-reviewed journals; -11
capítulos de livros; -1 livro
(Radicias livres: bons, maus e naturais. -h index = 34 (webofscienc, May 2012). |
Artigos selecionados
Augusto, O.,
Bonini, M. G., Amanso, A. M., Linares, E., Santos, C. C. X. and de Menezes, S.
L. (2002) Nitrogen dioxide and carbonate
radical anion: two emerging radicals in Biology. Free Radic. Biol.
Med. 32, 841-859.
Bonini, M. G., Radi, R.,
Ferrer-Sueta, G., da- Costa Ferreira, A. M. and Augusto, O. (1999) Direct
detection of the carbonate radical anion produced from peroxynitrite and carbon
dioxide. J. Biol. Chem. 274,
10802-1086.
Augusto, O., Beilan,
H. S. and Ortiz de Montellano, P. R.
(1982) The catalytic mechanism of cytochrome P450. Spin trapping evidence for
one-electron substrate oxidation. J.
Biol. Chem. 257, 11288-11295.
Augusto, O., Kunze, K. L. and Ortiz de Montellano, P. R.
(1982) N-phenyl protoporphyrin IX. Formation in the hemoglobin-phenylhydrazine
reaction: evidence for a protein-stabilized iron phenyl intermediate. J. Biol. Chem., 257, 6231-6241.
Quijano, C., Alvarez, B., Gatti, R. M., Augusto, O. and Radi, R. (1997)
Pathways of peroxynitrite oxidation of thiol groups. Biochem.l J. 322, 167-173.
Augusto, O., Gatti, R.M. and Radi, R. (1994) Spin-trapping studies of
peroxynitrite decomposition and of 3-morpholinosydnomine N-ethylcarbamide
auto-oxidation. Arch. Biochem. Biophys. 310, 118-125.
Gatti, R. M., Radi, R. and Augusto, O. (1994) Peroxynitrite-mediated
oxidation of albumin to the protein thiyl free radical. FEBS Letters 348, 287-290.
Laurindo, F. R. M., Pedro, M. A., Barbeiro, H. V., Carvalho, M. H. C.,
Augusto, O. and da-Luz, P. (1994) Vascular free radical release. Ex vivo and in vivo evidence for a flow-dependent endothelial mechanism.
Circ. Res. 74, 700-709.
Santos, C. X. C., Anjos, E. I. and Augusto, O. (1999) Uric acid
oxidation by peroxynitrite: multiple reactions, free radical formation and
amplification of lipid oxidation. Arch. Biochem. Biophys. 372, 285-294.
Bonini, M. G. and Augusto, O. (2001) Carbon dioxide stimulates the production of thiyl, sulfinyl, and dissulfide radical anion from thiol oxidation by peroxynitrite. J.Biol. Chem. 276, 9749-9754.
FINANCIAL SUPPORT


|
|
 |
http://www2.iq.usp.br/redoxoma/ |