

Laboratório
de Bioquímica de Parasitas
Responsáveis:
Maria Júlia Manso Alves e Walter Colli
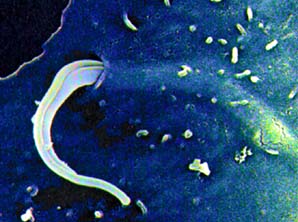 |
O
Trypanosoma cruzi, agente causador da doença de Chagas, é
parasita intracelular obrigatório. A adesão do parasita à
célula hospedeira desencadeia um sistema de transmissão de
sinais que culmina em sua internação. Uma vez no interior
da célula hospedeira o tripanossomo diferencia-se para outros estágios
e replica-se. |
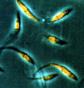
Interação de ligantes do parasita com receptores do hospedeiro
Para
entrar em células do hospedeiro os parasitas atravessam a barreira
de células endoteliais dos vasos e interagem com a membrana basal,
a membrana plasmática da célula alvo e as moléculas
da matriz extracelular. Procurar-se-á identificar (1) os segmentos
peptídicos de proteínas da superfície do parasita
responsáveis pela sua interação com receptores da
célula hospedeira; (2) os receptores da membrana de células
hospedeiras envolvidos na interação com o parasita e isolá-los;
(3) os sinais desencadeados na célula hospedeira em virtude de interações
do tipo ligante-receptor.
|

|
|
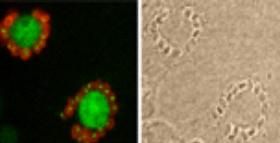
Diferenciação
do parasita no interior da célula hospedeira
Após
a invasão da célula hospedeira, o parasita passa por etapas
de divisão e diferenciação. É possível
arrestar a diferenciação da forma amastigota para a forma
tripomastigota, aparecendo uma forma intermediária muito semelhante
às formas epimastigotas encontradas no inseto vetor. Pretende-se
estudar: (1) as principais fontes de carbono usadas por essas formas; (2)
o transporte de açúcares e aminoácidos nessas formas
e compará-lo ao dos outros estágios do parasita; (3) os diferentes
estágios pela metodologia do proteoma buscando a expressão
diferencial de proteínas e o aparecimento de mRNAs estágio-específicos. |
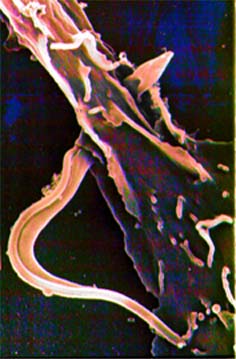
| Estudo
de enzimas específicas do parasita
O laboratório
interessa-se por enzimas que sejam específicas do parasita tendo
como meta principal interferir no seu metabolismo sem alterar o metabolismo
do hospedeiro. No momento, em colaboração com outros grupos,
estuda-se o metabolismo da galactofuranose, um açúcar ausente
em mamíferos e descrito em protozoários por nosso grupo,
pela primeira vez na literatura. Procura-se especificamente por uma galactofuranosidase
e por questões comparativas a mesma enzima de P. fellutanum, um
fungo não patogênico, está sendo purificada e seu gene
clonado. |
 |
Avenida
Professor Lineu Prestes 748, Cidade Universitária
Bloco
10 Inferior, salas 1020, 1022
Instituto
de Química, Universidade de São Paulo
Caixa
Postal 26077, 05599-970 São Paulo

MARIA
JÚLIA MANSO ALVES
mjmalves@quim.iq.usp.br
3818-3812/3810
WALTER
COLLI
walcolli@usp.br
3818-2175/3812/3810
Trabalhos
selecionados
Almeida-de-Faria, M., Freymüller, E., Colli, W. and Alves, M.J.M.
(1999) Trypanosoma cruzi: characterization of an intracellular epimastigote-like
form. Exp. Parasitol. 92, 263-274.
Miletti, L.C., Marino, C., Mariño, K., Lederkremer, R.M., Colli,
W & Alves, M.J.M. (1999) Immobilized 4-aminophenyl 1-thio-b-D-galactofuranoside
as a matrix for affinity purification of an exo-b-D-galactofuranosidase.
Carbohydr. Res. 320, 176-182.
Abuin, G., de Freitas-Júnior, L.H.G., Colli, W., Alves, M.J.M.
and Schenkman, S. (1999) Expression of trans-sialidase and 85-kDa
glycoprotein genes in Trypanosoma cruzi is differentially regulated at
the post-transcriptional level by labile protein factors. J. Biol. Chem.
274, 13041-13047.
Giordano, R., Fouts, D.L., Tewari, D., Colli, W., Manning, J.E. &
Alves, M.J.M. (1999) Cloning of a surface membrane glycoprotein specific
for the infective form of Trypanosoma cruzi having adhesive properties
to laminin. J. Biol. Chem. 274, 3461-3468.
Abuin, G., Couto, A.S., Lederkremer, R.M., Casal, O.L., Galli, C., Colli,
W. & Alves, M.J.M. (1996) Trypanosoma cruzi: the Tc-85 surface glycoprotein
shed by trypomastigotes bears a modified glycosylphosphatidylinositol anchor.
Exp. Parasitol. 82, 290-297
Giordano, R., Chammas, R., Veiga, S.S., Colli, W. & Alves, M.J.M.
(1994) An acidic component of the heterogeneous Tc-85 protein family from
the surface of Trypanosoma cruzi is a laminin binding glycoprotein. Mol.
Biochem. Parasitol. 65, 85-94.
Revisões
pertinentes
Colli, W. & Alves, M.J.M. (1999) Relevant glycoconjugates on the
surface of Trypanosoma cruzi. Mem. Inst. Oswaldo Cruz 94, 37-49.
Alves, M.J.M. (1996). Members of the Tc-85 protein family from Trypanosoma
cruzi are adhesion proteins. Braz. J. Med. Biol. Res. 29, 831-833.
Lederkremer, R.M. and Colli, W. (1995) Galactofuranose-containing glycoconjugates
in Trypanosomatids. Glycobiology 5, 547-552.
Colli, W. (1993) Trans-sialidase: a unique enzyme activity discovered
in the protozoan Trypanosoma cruzi. FASEB J. 7, 1257-1264.







