
Os orbitais naturais de ligação (NBOs) constituem um dos conjuntos de base que ser usados para construir, por meio de uma combinação linear, a função de onda Ψ de uma molécula. Esses orbitais proporcionam a mais precisa representação possível da estrutura natural de Lewis (NLS), porque todos os detalhes foram matematicamente otimizados para incluir a maior porcentagem possível da densidade eletrônica. Sendo assim, os NBOs são considerados o conjunto de bases do químico, ao demonstrar como funções de onda ab initio modernas podem ser colocadas em harmonia com pontos de vista qualitativos anteriores.
Para uma determinada espécie, atribui-se uma função de onda psi que a descreve e é obtida pela equação de Shrödinger. Essa função Ψ pode ser descrita a partir de diversos conjuntos de base.
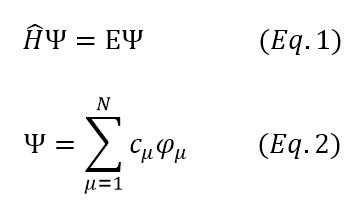
Alguns conjuntos de funções base importantes são apresentados abaixo, em ordem de composição. Ou seja, cada orbital do conjunto seguinte é formado a partir da combinação dos orbitais do conjunto anterior.
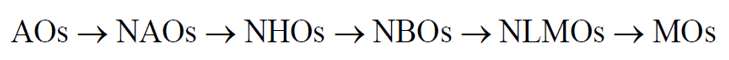
• AOs – orbitais atômicos • NAOs – orbitais naturais atômicos • NHOs – orbitais naturais híbridos • NBOs – orbitais naturais de ligação • NLMOs – orbitais naturais moleculares localizados • MOs – orbitais moleculares (deslocalizados)
Os orbitais naturais são assim chamados porque são “escolhidos” pela própria função de onda como ideais para sua descrição, isto é, a função é a única informação que aparece em sua definição. Matematicamente, os NOs de uma função psi são os auto-orbitais do operador de densidade (Γ), que se trata de uma “projeção” monoeletrônica da distribuição de probabilidade N-eletrônica |Ψ|².

Outra caracterização para os orbitais naturais assiste no fato de eles serem os orbitais de máxima ocupação.
Tomando, especificamente, os NBOs, eles são orbitais localizados de poucos centros (tipicamente 1 ou 2) e de máxima ocupação que são compostos a partir dos orbitais naturais híbridos (NHOs) {ha}. Estes, por sua vez, formam-se a partir da combinação linear otimizada dos NAOs em um dado átomo.
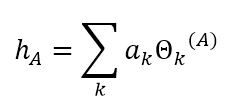
Tipos de NBO: • NBOs internos (“core”) – têm caráter muito próximo ao de NAO. • NBOs de pares de elétrons não ligantes (nA) – são compostos de um único NHO.
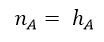
• NBOs ligante e antiligante – são combinações lineares normalizadas de 2 NHOs.
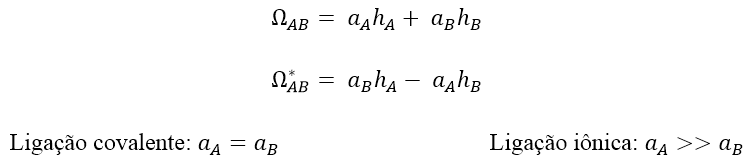
Embora os NBOs antiligantes não tenham papel na descrição da estrutura de Lewis no estado fundamental, eles são os orbitais “aceptores de elétrons” mais importantes, contribuindo para a estabilização.
• NBOs do tipo Rydberg – têm ocupação ínfima, podendo ser desconsiderados na maioria dos propósitos químicos.
No âmbito dos orbitais naturais de ligação, é importante, também, citar as interações orbitalares, que constituem um notório fator de estabilização de uma molécula. Por meio da teoria NBO, pode-se quantificar a energia correspondente à interação de um orbital preenchido (σ – doador) e um vazio (σ* – receptor).
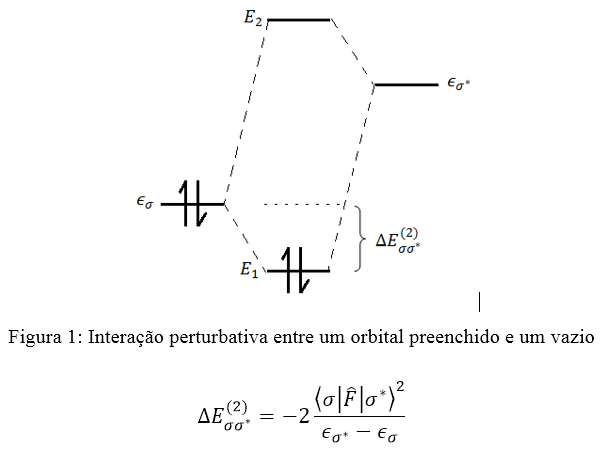
A análise dos orbitais naturais de ligação permite decompor a energia eletrônica em um grande número de perturbações. Isso permite verificar como as interações em determinadas regiões da molécula são influenciadas por alterações estruturais como a inclusão de grupos eletronegativos ou variações na geometria de confôrmeros.
Usando, como exemplo de molécula, a metilamina, o input do cálculo para a análise dos NBOs é apresentado abaixo. # RHF/3-21G pop=nbo Methylamine...RHF/3-21G//Pople-Gordon standard geometry 0 1 C N 1 1.47 H 1 1.09 2 109.4712 H 1 1.09 2 109.4712 3 120. 0 H 1 1.09 2 109.4712 3 240. 0 H 2 1.01 1 109.4712 3 60. 0 H 2 1.01 1 109.4712 3 300. 0
Como resultado do cálculo, as principais informações obtidas, na forma de tabelas, são estas abaixo.
• Ocupação e energia dos orbitais naturais atômicos (NAOs); • Resumo das cargas naturais atômicas; • Configuração eletrônica natural; • Detalhes da ocupação dos orbitais internos (“core”), de valência e Rydberg: Essa seção mostra a qualidade geral da descrição da estrutura natural de Lewis por meio da porcentagem da densidade eletrônica; • Tabela principal dos NBOs, apresentando tipo e composição: Nesse caso, um exemplo é a composição dos orbitais ligante e anti-ligante C–N;
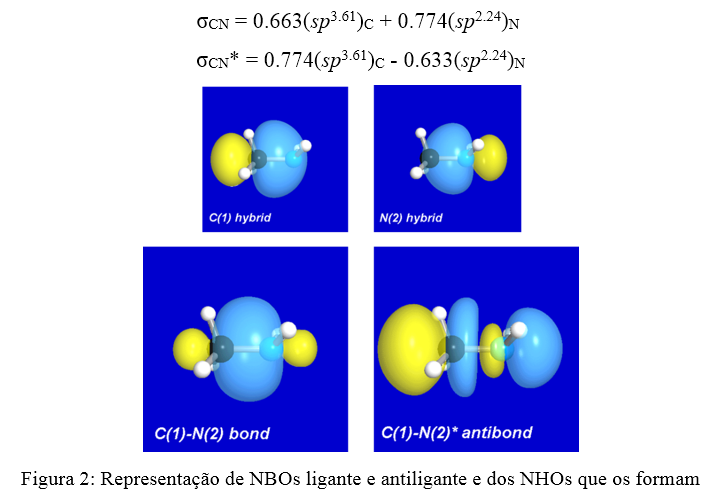
• Propriedades angulares dos NHOs; • Análise das interações perturbativas de segunda ordem (interações orbitalares).
Um tutorial detalhado sobre como interpretar cada seção do output desse cálculo pode ser encontrado na plataforma sobre NBO da Universidade de Wisconsin
Em posse da geometria otimizada, criar o input com os seguintes comandos (partes em vermelho são necessárias para que se possa plotar os orbitais): %mem=15Gb %nproc=4 #P B3LYP/6-311+G(3df,2p) Pop=(Full,NBORead) gfoldprint NBO Int1 NF3 plot -1 1 6 -1.310392000 -0.287058000 1.576782000 1 -1.787647000 0.447923000 2.232171000 1 -0.623288000 -0.890046000 2.170899000 1 -2.104120000 -0.892634000 1.092636000 14 -0.477359000 0.570213000 0.168297000 8 0.497667000 -0.709636000 -0.666517000 6 0.715933000 1.929736000 0.673650000 1 0.137173000 2.724675000 1.153697000 1 1.463161000 1.573745000 1.381462000 1 1.233996000 2.355305000 -0.185465000 6 -1.649052000 1.049424000 -1.176032000 1 -2.174365000 1.970471000 -0.906312000 1 -1.154765000 1.202552000 -2.137113000 1 -2.387576000 0.218409000 -1.200946000 7 1.685431000 -1.094947000 -0.517994000 9 2.575388000 0.061645000 -0.948439000 9 1.989982000 -1.025060000 0.946597000 9 -3.258462000 -1.203727000 -0.380991000 $NBO BNDIDX PLOT $END
Além do arquivo .log, serão gerados os arquivos de FILE.31 a FILE.41. O primeiro contém informações das coordenadas de cada átomo e cada um dos outros permite visualizar diferentes tipos de orbitais. Para visualizar os NBOs, serão necessários os arquivos FILE.31 e FILE.37.
Transferir todos os arquivos FILE.* no computador para a mesma pasta e abrir o FILE.31 no Chemcraft. Os outros arquivos serão identificados e abertos em conjunto (se o .log também estiver na pasta, ele também será aberto).
Selecionar, no Chemcraft, FILE37 (NBOs). Em “Tools”, clicar em “Render molecular orbitals”, selecionar os orbitais a serem mostrados e confirmar. Abaixo dos FILE.* na aba lateral do Chemcraft, aparecerão os orbitais selecionados. É possível clicar em um e selecionar a opção “Show isosurface” para visualizá-lo. Usando a opção “Keep this surface”, consegue-se mostrar mais de um orbital ao mesmo tempo na imagem.